蛋白互作檢測之磁珠法Co-IP技術
蛋白是基因功能的執行者,是基因發揮功能的關鍵分子。不同蛋白質之間通過蛋白質相互作用(protein-protein interaction,PPI)形成互作網絡參與生物信號傳遞、基因表達調節、能量和物質代謝及細胞周期調控等生命過程。深入解析PPI網絡對揭示蛋白質在生物過程中的功能,闡明疾病等特殊生理狀態下生物信號和能量物質代謝的反應機制具有重要意義。今天將為大家分享生物研究中常用蛋白質互作檢測技術和方法,與大家共同學習耳熟能詳的免疫共沉淀技術(Co-IP)及相關的免疫沉淀-質譜技術(Co-IP-MS),歡迎點贊關注,多多交流指正。
免疫沉淀(Immunoprecipitation,IP)是基于抗原-抗體特異性結合的特性,利用抗體將目的蛋白從復雜樣本中富集出來的一種生物學手段。由此衍生出來的免疫共沉淀(Co- Immunoprecipitation,Co-IP)則是基于IP的原理,研究蛋白質相互作用的一種手段,能夠有效確定兩種蛋白質在細胞內的生理性相互作用,是蛋白互作檢測的金標準。
一. Co-IP實驗的主要原理
Co-IP實驗的主要原理是利用抗原-抗體特異性結合的特性,將特異性抗體加入到含有目的蛋白樣本溶液中,抗體與目的蛋白特異性結合。Protein A/G融合Protein A和Protein B的IgG結合結構域,能與抗體的Fc片段特異性結合,因此利用固定在磁珠上的Protein A/G可以與目的蛋白-抗體復合物結合形成復合體。最終通過離心或磁分離、收集、洗脫、溶解等步驟獲得目的蛋白以及與目的蛋白互作的蛋白質,實現從復雜樣本中富集目的蛋白及相關互作蛋白。
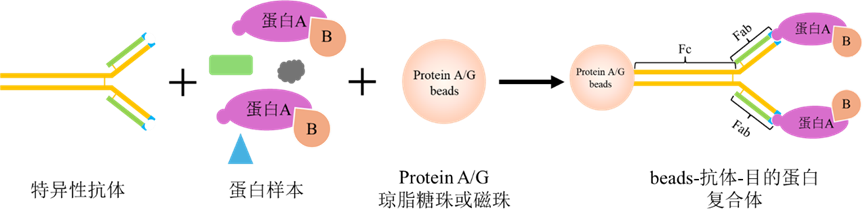
免疫沉淀原理示意圖(圖片來源于網絡)
二. Co-IP的技術特點
1. 技術優勢
體內天然狀態下驗證互作,接近正常生理水平;蛋白處理細胞生理環境下,避免人為干擾;分離天然狀態下的蛋白進行功能檢測。
2. 技術不足
無法檢測弱相互作用和瞬時相互作用;檢測直接相互作用,對于間接相互作用檢測效果差;對抗體要求高。
三. Co-IP的實驗前準備
1、蛋白裂解液選擇
為避免破壞蛋白相互作用,Co-IP實驗對蛋白裂解液具有一定要求:
(1)使用非變性溫和裂解液;
(2)使用溫和的非離子去垢劑如NP-40,Triton X-100,避免使用SDS等離子型去垢劑。
2、抗體選擇
(1)選擇經過IP驗證的抗體,從而識別目的蛋白天然構象;
(2)若無合適的IP級別抗體,則可添加標簽蛋白,使用IP級別的標簽抗體進行相關實驗;
3、固相支持物選擇
Co-IP實驗常用固相支持物主要有瓊脂糖珠和磁珠兩種(具體請參考網頁http://www.posuichina.com/Product/0293713052.html),二者主要區別為:
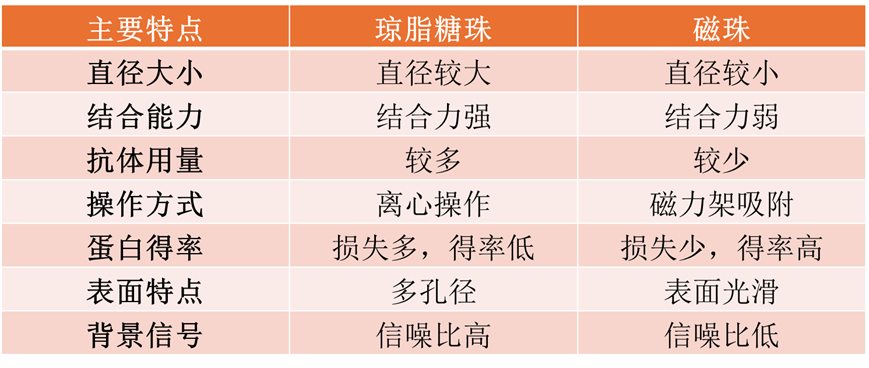
4、洗脫方式
不同洗脫液對于蛋白構象和相互作用影響較大,Co-IP實驗需根據不同實驗需求選擇不同洗脫方式:
(1)非變性洗脫:通常使用低pH洗脫液進行洗脫(如pH 2.5-3.0的0.1 M甘氨酸溶液),此類洗脫方式能夠保留蛋白質的天然結構,便于蛋白的功能驗證如酶活檢測;
(2)變性洗脫:通常使用蛋白上樣緩沖液進行洗脫,此類洗脫方式會破壞蛋白結構,通常用于互作蛋白鑒定如Western blot。
四. Co-IP的實驗流程
1、根據實驗需求對培養細胞并進行相應處理(如細胞轉染、藥物處理等);
注意:若是組織樣本,則對組織破碎后直接跳轉到步驟3。
2、收集處理后的細胞并吸棄培養基,刮下細胞并收集于1.5 mL離心管中,4 ℃, 1000 rpm條件下離心5 min,棄上清;
3、使用4 ℃預冷的PBS洗滌細胞3次,4 ℃, 500 g條件下離心5 min,棄上清;
注意:
(1)IP實驗流程需在冰上進行,避免蛋白出現降解;
(2)實驗中的試劑使用前需在4 ℃預冷處理;
4、加入500 μL含蛋白酶/磷酸酶抑制劑的IP裂解液,輕輕吹打混勻后置于冰上裂解細胞30 min;
注意:
(1)IP裂解液根據樣本量使用,避免裂解不徹底或者目的蛋白濃度過低;
(2)保證加入蛋白酶/磷酸酶抑制劑,避免目的蛋白降解;
(3)保證裂解時間充足,避免裂解不徹底;
(4)裂解時可將樣本置于搖床,增加裂解液與樣本接觸面積;
5、裂解完成后,4 ℃,12000 rpm條件下離心30 min,取上清轉移至新的1.5 mL EP管中;
6、預留20 μL上清液作為WB的Input樣本,剩余上清中加入適量抗體,輕輕吹打混勻后4 ℃翻轉搖床孵育過夜或常溫翻轉孵育2 h;
注意:
(1)需使用IP級別抗體,最好為單抗,避免非特異性結合;
(2)建議4 ℃翻轉孵育過夜,低溫有助于降低非特異性結合;
(3)抗體按照說明書確定用量,避免用量過多導致非特異性結合;
(4)可將上清溶液分為兩份,一份加入特異性抗體作為IP組,另一份加入與特異性抗體同源的IgG抗體作為陰性對照組(IgG組)
7、取適量Protein A/G beads并利用IP裂解液清洗3遍;
注意:
(1)儲存珠子的液體與IP實驗不兼容,使用時需對beads進行清洗;
(2)取珠子時可將槍頭稍微剪成適當大小斜口,避免珠子堵塞槍頭或者槍頭破壞珠子;
(3)磁珠和瓊脂糖珠與抗體結合條件不同,需根據珠子類型選擇合適孵育時間;磁珠常溫下旋轉孵育20 min即可,瓊脂糖珠則通常在4 ℃旋轉孵育1-4 h;
8、將清洗后的Protein A/G beads(以瓊脂糖珠為例)加入抗體孵育完成后的溶液中,4 ℃翻轉搖床孵育1-4 h;
注意:
(1)需保證足量的beads,避免beads用量不足以結合抗體-目的蛋白復合物;
(2)beads孵育時間可通過預實驗進行調整,避免因孵育時間過短或過長導致富集效果差或者非特異性結合;
9、Protein A/G beads孵育完成后,4 ℃,2000 rpm條件下離心5 min,收集beads;
10、加入1 mL IP裂解液,輕柔顛倒混勻后置于冰上靜置2-3 min洗滌protein A/G-beads,4 ℃,2000 rpm條件下離心5 min,收集beads;
12、重復步驟10,洗滌beads 10次;
注意:
(1)步驟9-12需輕柔進行,避免破壞beads-抗體-目的蛋白復合體;
(2)清洗次數會影響最終結果,清洗次數過多會導致弱結合蛋白被洗脫,檢測信號弱;清洗次數過低會導致非特異性結合未被清洗干凈,信噪比高;
13、根據檢測方法選擇合適的洗脫方法對beads上的蛋白進行洗脫,最終獲得目的蛋白;
注意:
(1)抗體和beads為非共價結合,會一同被洗脫;
(2)Western blot實驗通常使用3×蛋白上樣緩沖液進行洗脫,洗脫效率高,可同時對蛋白變性處理,便于后續檢測;
(3)若進行其他檢測如酶活性檢測,則需使用兼容下游實驗的洗脫緩沖液進行洗脫;
14、利用Western blot或者質譜分析的方法對目的蛋白進行檢測;
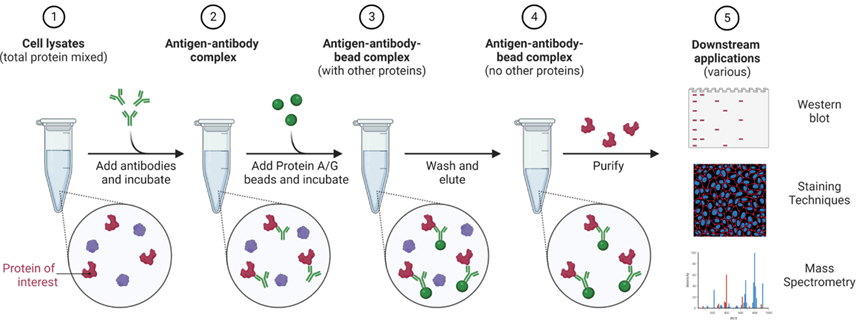
IP實驗流程示意圖
五. Co-IP的實驗結果判讀
1、已知蛋白互作驗證(內源蛋白)
對于已知蛋白是否存在相互作用,通常利用Western blot進行檢測,實驗通常包含Input樣本、IgG樣本以及IP樣本,其中Input樣本和IgG樣本分別可作為陽性對照和陰性對照,IP樣本則用于檢測蛋白是否存在互作。
Input組:陽性對照組,抗體富集前預留樣本,檢測蛋白A和B的表達情況;
IgG組:陰性對照組,無條帶,用于排除IP組出現非特異性條帶;
IP組:實驗組,用于檢測蛋白A和蛋白B是否存在互作。

上圖檢測內源蛋白A和蛋白B是否互作。Input組蛋白A和蛋白B均正常檢出目的條帶,表明蛋白A和蛋白B表達正常,抗體有效;IgG組未檢出條帶,表明抗體無非特異結合;利用蛋白A的抗體進行IP富集,蛋白A表達較Input組明顯增多,表明對蛋白A富集成功。圖(左)中蛋白B檢出條帶,證明用抗體A富集后的樣本中包含蛋白B,蛋白A和蛋白B存在相互作用。圖(右)中蛋白B未檢出條帶,證明用抗體A富集后的樣本中不包含蛋白B,蛋白A和蛋白B不存在相互作用。
注意:Co-IP實驗通常進行正拉(抗體A富集檢測蛋白B)和反拉(抗體B富集檢測蛋白A)實驗進行互作檢測,兩次結果結尾陽性時證實蛋白A和蛋白B存在相互作用。
2、已知蛋白互作驗證(外源質粒高表達)
對于轉染基因表達質粒時,樣本通常分為3組,Protein A、Protein B以及Protein A+ Protein B,可使用IgG作為陰性對照,對于目的蛋白無IP級別抗體時可使用標簽抗體進行相關檢測。
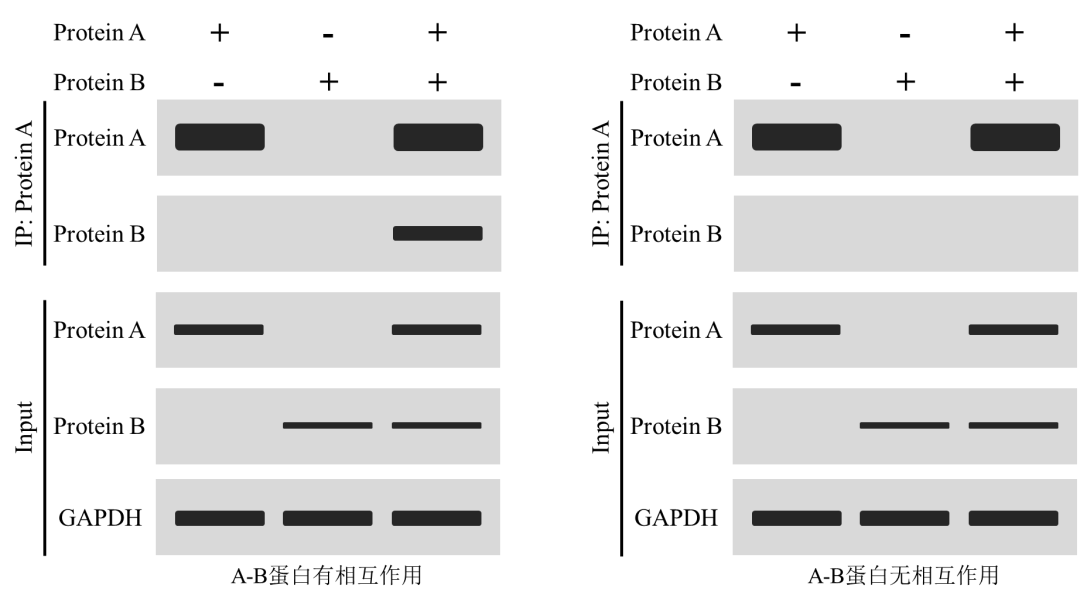
上圖為分別轉染基因A和基因B表達質粒后分析蛋白A和蛋白B是否互作。圖中Input結果內參蛋白GAPDH均檢出條帶,表明蛋白提取過程正常,蛋白A和蛋白B均檢測目的條帶,表明質粒正常表達;圖(左)中,利用蛋白A的抗體進行富集,蛋白A組和Protein A + Protein B組中均可檢出蛋白A條帶,表明蛋白A抗體IP富集成功,Protein A + Protein B組中檢測蛋白B條帶,證明用抗體A富集后的樣本中包含蛋白B,蛋白A和蛋白B存在相互作用。圖(右)Protein A + Protein B組中未檢出蛋白B條帶,證明用蛋白抗體A富集后的樣本中不包含蛋白B,蛋白A和蛋白B不存在相互作用。
3、未知互作蛋白篩選
對于篩選與目的蛋白存在相互作用的潛在蛋白,通常利用質譜技術進行分析。首先利用Western blot技術對IP結果進行檢測,確認抗體成功富集目的蛋白后對樣本進行質譜分析。Western blot檢測包含Input樣本、IgG樣本以及IP樣本,其中Input樣本和IgG樣本分別可作為陽性對照和陰性對照,IP樣本則用于檢測蛋白富集效果;質譜分析時可將IgG樣本作為陰性對照,排除假陽性信號。
如上圖所示,Input組蛋白A正常檢出目的條帶,表明蛋白A表達正常,抗體有效;IgG組未檢出條帶,表明抗體無非特異結合;利用蛋白A的抗體進行IP富集,蛋白A表達較Input組明顯增多,表明對蛋白A富集成功。隨后對IP富集后的beads進行蛋白洗脫后質譜鑒定除Protein B、Protein C等,后續可通過Co-IP對感興趣的蛋白進行進一步互作驗證。
廈門普睿邁格生物科技有限公司提供各類磁珠http://www.posuichina.com/Product/,用于化學生物學研究。
六. Co-IP的實驗問題與分析
1、Co-IP結果無信號
原因1:目的蛋白表達低,或者IP富集效果差
根據Input組和IP組目的蛋白檢測結果分析原因,酌情考慮使用外源表達質粒進行目的基因高表達或者加大用于IP富集的蛋白裂解物。
原因2:蛋白互作程度低
使用外源質粒對互作蛋白高表達,增加蛋白裂解樣的使用,或者使用適當手段誘導互作。
原因3:裂解液使用不當
變性裂解液會破壞蛋白相互作用,建議使用溫和型非變性裂解液處理樣本,操作過程中盡量輕柔,避免破壞蛋白相互作用。
原因4:抗體使用不足或者效用差
通過根據Input結果分析抗體效用,若抗體工作效果較好,則可增加IP過程中抗體用量。
原因5:beads與抗體結合效果差
根據實驗需求選擇適合的瓊脂糖珠或者磁珠,并且使用beads前檢測beads是否保存不當導致過期或者失效。
2、Co-IP結果雜帶多,背景干擾嚴重
原因1:beads結合后洗滌次數不足,清洗不徹底
增加洗滌次數,適當梯度增加洗滌液中NaCl和去垢劑的濃度。
原因2:抗體特異性差或者IP富集時抗體濃度過高
分析Input組條帶信號,根據Input結果考慮降低IP富集時抗體使用濃度或者更換抗體。
原因3:IP富集時樣本用量過多或者實驗過程中蛋白降解
根據實驗結果適當減少細胞裂解樣本量,并且保證實驗過程在冰上進行,裂解液中加入足量蛋白酶抑制劑和磷酸酶抑制劑。
原因4:洗脫后的WB檢測實驗過程中操作不規范
嚴格按照WB實驗流程,注意轉膜時間、膜封閉條件、一抗和二抗稀釋比例、孵育時間等,一抗孵育建議4℃過夜進行,低溫有助于降低非特異性結合。
原因5:抗體重鏈或者輕鏈干擾
IP實驗出現非特異性條帶位置位于55 kDa附近或者25 kDa附件時可考慮IgG重鏈或者輕鏈的干擾。對于此類情況,盡量在IP富集與WB檢測時選擇不同種屬來源的抗體(例如IP抗體為兔抗,WB抗體則選擇鼠抗)。
3、IgG組中檢出非特異性條帶
原因1:IgG與非特異性抗體結合
若IgG組中檢出非特異性條帶,可適當增加beads清洗次數以及洗滌液中NaCl和去垢劑的濃度;或者適當降低抗體使用濃度;
原因2:IgG抗體自身問題
更換陰性對照的IgG抗體,或者在IP富集與WB檢測時選擇不同種屬來源的抗體。
七. Co-IP技術應用案例
1、驗證蛋白-蛋白相互作用


Co-IP檢測內源性STX11和SNAP25蛋白相互作用。Input組檢出STX11和SNAP25目的蛋白,表明抗體工作正常;利用STX11抗體IP富集后檢出SNAP25蛋白,SNAP25抗體IP富集后同樣檢出STX11蛋白,表明STX11與SNAP25存在相互作用。
2、蛋白修飾研究

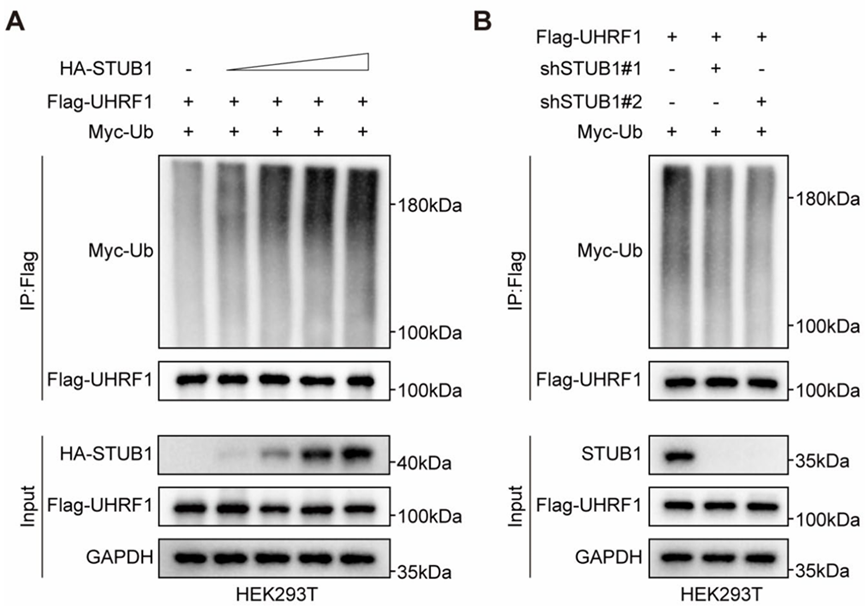
利用Co-IP檢測泛素E3連接酶STUB1對UHRF1的泛素化修飾作用。圖A中,Input結果顯示GAPDH和Flag-UHRF1表達正常,HA-STUB1隨加入量表達逐漸升高;IP:Flag結果顯示,利用Flag抗體進行IP富集后,Flag-UHRF1正常檢出,表明IP富集正常,Myc-Ub檢出,且條帶隨STUB1加入量增加而逐漸升高,表明UHRF1與E3連接酶SUTB1相互作用被泛素化修飾。圖B中,干擾STUB1的表達,導致IP:Flag組中Myc-Ub條帶減弱,表明STUB1的敲低抑制UHRF1的泛素化修飾。PS:Myc-Ub是泛素分子,在進行泛素化修飾實驗中提供所需的泛素分子。
3、篩選疾病標志物

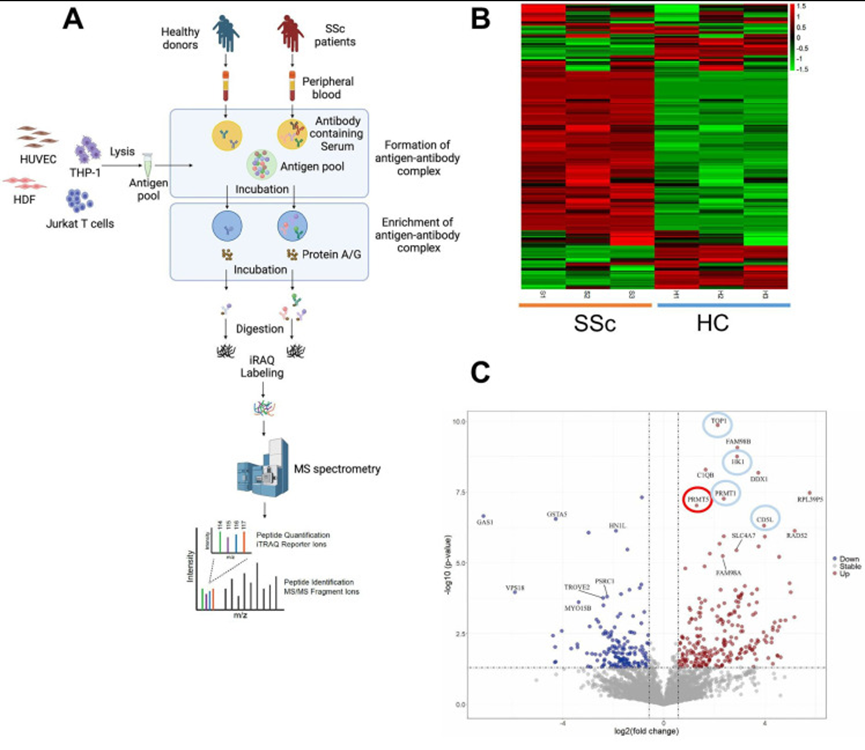
研究人員通過使用源自細胞裂解物的抗原庫,對系統性硬化癥(SSc)患者或健康供體的血清利用磁珠進行IP富集。富集的抗原-抗體復合物進行質譜(MS)分析鑒定,并對候選差異抗體在兩組獨立的SSc患者中進行正交驗證,結果顯示顯示SSc患者的抗PRMT5抗體顯著升高。并且候選差異抗體在區分SSc與健康對照和其他自身免疫性疾病(包括系統性紅斑狼瘡和干燥綜合征)方面表現出強大的診斷準確性,曲線下面積范圍為0.900至0.988。結合分子生物學實驗最終證實抗PRMT5抗體在SSc中的潛在關鍵作用。
4、篩選下游互作蛋白或藥物靶點

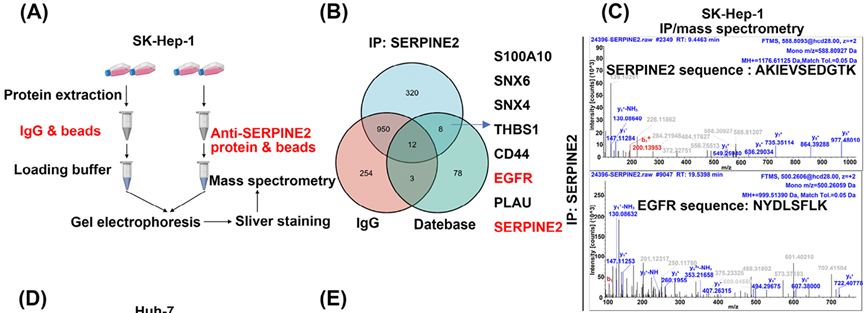
為了鑒定SERPINE2相關蛋白并探索SERPINE2在肝癌轉移中的潛在分子機制,研究人員利用SERPINE2抗體進行IP富集后,以IgG抗體作為陰性對照,通過質譜分析與SERPINE2存在互作的潛在蛋白,并結合STRING數據庫的數據確定了7種潛在的SERPINE2相互作用蛋白,并通過Co-IP證實SERPINE2與EGFR存在相互作用。廈門普睿邁格生物科技有限公司提供各類磁珠http://www.posuichina.com/Product/,用于化學生物學研究。
- 上一篇:蛋白互作檢測之磁珠法Pull-down技術精解 2025/5/18
- 下一篇:基于納米顆粒的血漿蛋白質組學中血液成分污染的系統性評估 2025/5/17

