蛋白互作檢測之磁珠法Pull-down技術精解
1988年,澳大利亞兩位科學家Donald B. Smith和Kevin S. Johnson首次提出谷胱甘肽S-轉移酶(Glutathione S-Transferase, GST)親和標簽的概念,并成功從細菌中一步純化出高純度GST融合蛋白。此后,目的蛋白融合GST標簽后進行親和純化被廣泛使用,至今仍是純化重組蛋白常用的方法,由此衍生的GST Pull-down技術同樣是蛋白互作研究重要手段之一。
一. Pull-down技術原理
Pull-down是指利用生物素、His或者GST等標簽與已知蛋白融合表達作為誘餌蛋白,隨后將誘餌蛋白純化或固定在與其親和的固相支持物上(磁珠),與蛋白樣本或者包含蛋白樣本的裂解液共孵育,進而捕獲能夠與誘餌蛋白相互作用的蛋白質,最終通過洗滌、洗脫、WB檢測或者質譜分析等手段獲得與誘餌蛋白存在相互作用的蛋白的一種方法。按照標簽類型可分為GST Pull-down、His Pull-down、生物素-Pull-down等。
GST Pull-down技術即是基于Pull-down的原理,將已知蛋白與GST標簽融合表達純化并固定在含谷胱甘肽(GSH)的瓊脂糖珠上(磁珠購買請參考http://www.posuichina.com/Product/3249714524.html),形成已知蛋白-GST-GSH-瓊脂糖珠復合體,隨后與蛋白樣本共孵育,捕獲與已知蛋白相互作用蛋白并進行Western blot檢測或者質譜鑒定。
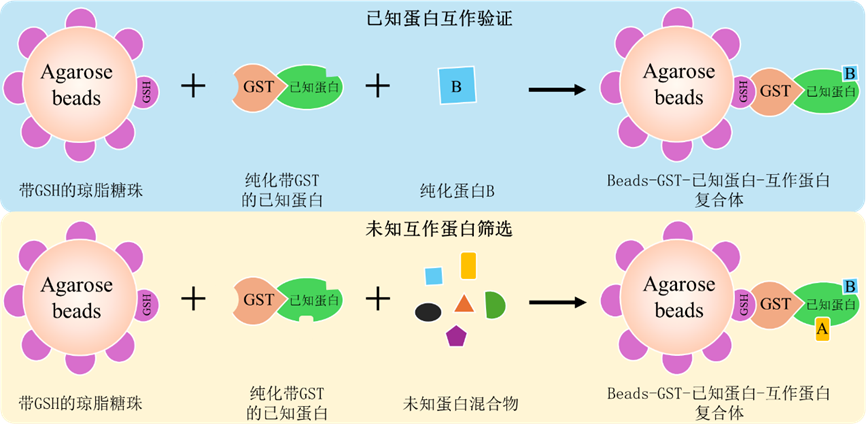
圖GST Pull-down原理示意圖
二. Pull-down技術特點
1、技術優勢
-
直接驗證蛋白相互作用,證據扎實;
-
蛋白標簽與固相支持物親和力強,洗脫純度高;
-
無需抗體,親和作用結合,富集效果好;
2、技術缺陷
-
需將蛋白通過原核表達系統純化出來,增加實驗難度;
-
體外驗證互作,無法反映體內真實互作狀態;
-
無法檢測間接相互作用或者弱相互作用;
-
部分標簽較大,可能影響蛋白構象,造成假陰性;
-
蛋白可能因強電荷作用結合,造成假陽性;
三. Pull-down常用標簽
通常能用于蛋白純化的標簽都可用于Pull-down實驗,一般常用蛋白純化標簽如GST、His、MBP、SUMO以及生物素等,具體特點如下:
(1)GST標簽:大小為26 kDa,使用GSH親和純化,廣泛應用于各種融合蛋 白表達,能夠形成高度可溶的蛋白,且在大腸桿菌中能夠大量表達,但分子量較大,可能影響蛋白構象;
(2)His標簽:大小為0.84 kDa,使用Ni柱純化,在非離子型表面活性劑存在 或者變性條件下純化,能夠純化包涵體蛋白,純化條件相對溫和;
(3)Flag標簽:大小1.01 kDa,可直接通過FLAG親和層析進行非變性純化, 純化效率高,并且在真核表達系統中效率高;
(4)MBP標簽:大小為40 kDa,全稱為麥芽糖結合蛋白標簽,使用MBP結合 基質(丙糖醛酸瓊脂糖樹脂,amylose resin)進行純化,能夠減少目的蛋白降解,增加蛋白表達量和穩定性,MBP序列N端含有信號肽,適用于毒性蛋白純化,但標簽較大,可能影響目的蛋白空間構象;
(5)SUMO標簽:大小11.5 kDa,是小分子泛素相關修飾蛋白,能夠促進蛋白正確折疊,并且具有耐熱和耐蛋白酶特性,能夠保持純化蛋白的穩定性;
(6)NusA標簽:大小為54.9 kDa,不具備獨立的純化標簽,需與His等標簽聯用后親和純化,能夠極大提高蛋白可溶性,但可能影響蛋白空間構象;
(7)生物素(Strep)標簽:大小為1.06 kDa,可用生物素親和純化,偏好真核表達系統,目的蛋白純度高;
四. Pull-down技術流程
1、融合蛋白小量表達測試(以GST Pull-down為例)
(1)選擇GST純化標簽和適當表達載體并構建GST-蛋白A表達質粒;
(2)將表達質粒轉化至宿主細胞如大腸桿菌BL21中,培養至適當密度(OD = 0.6-0.8)后,加入異丙基硫代半乳糖苷(IPTG)進行蛋白表達誘導;
注意:IPTG濃度一般設置在0.3-1.0 mM之間;IPTG誘導溫度通常設置常溫(28 ℃)和低溫(16 ℃)兩組;IPTG誘導時間設置4-18 h之間;
(3)分別設置不同IPTG使用濃度、培養溫度以及培養時間進行蛋白表達誘導;
(4)蛋白表達誘導完成后,分別收集不同條件下誘導培養的菌體,加入PBS后超聲破碎,收集上清;
(5)加入Loading Buffer煮樣后Western blot檢測GST-蛋白A表達效果;
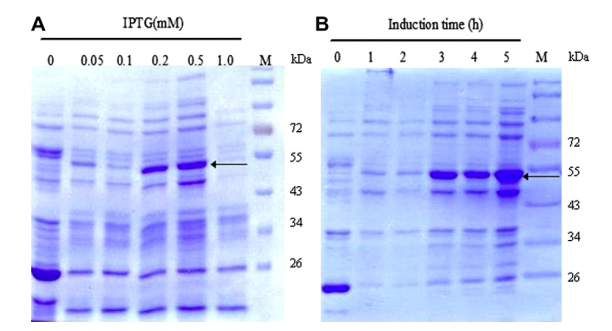
圖 蛋白表達結果示意圖(圖片來源于網絡)
2、蛋白大量表達純化
(1)根據小量表達測試結果,選擇最適宜的IPTG使用濃度、誘導溫度和時間,進行GST-蛋白A大量表達誘導;
(2)誘導結束后,收集菌體加入PBS后進行超聲破碎,收集上清;
(3)使用GST純化柱對到蛋白進行純化獲得GST-蛋白A;
(4)取適量純化后的蛋白,進行考馬斯亮藍染色檢測蛋白純度和濃度;
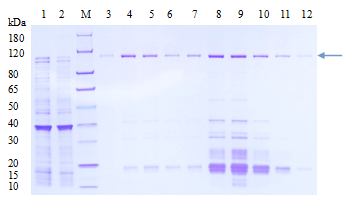
圖 蛋白純化結果示意圖(圖片來源于網絡)
3、Pull-down實驗
若互作蛋白B同樣通過蛋白表達純化,可直接按照步驟(4)進行Pull-down實驗;若互作蛋白B未通過蛋白表達純化或互作蛋白未知,則需按照步驟(1)-(3)準備互作蛋白樣本。
(1)培養并處理細胞(質粒轉染、藥物處理等);
(2)選擇適當細胞裂解液(含蛋白酶抑制劑、磷酸酶抑制劑)對細胞進行裂解;
(3)離心,去除細胞碎片,收集上清;
(4)將制備好的GST-蛋白A固定到GSH-瓊脂糖磁珠上(磁珠購買請參考http://www.posuichina.com/Product/3249714524.html),形成beads-GSH-GST-蛋白A復合體;
(5)將蛋白B或者細胞裂解液與beads-GSH-GST-蛋白A復合體共孵育,形成beads-GSH-GST-蛋白A-蛋白B復合體;
注意:通常設置beads-瓊脂糖磁珠與裂解液共孵育作為陰性對照組;
(6)洗滌去除非特異性結合蛋白;
(7)利用洗脫緩沖液洗脫目的蛋白并收集目的蛋白;
(8)Western blot檢測已知蛋白B或者質譜分析未知蛋白;
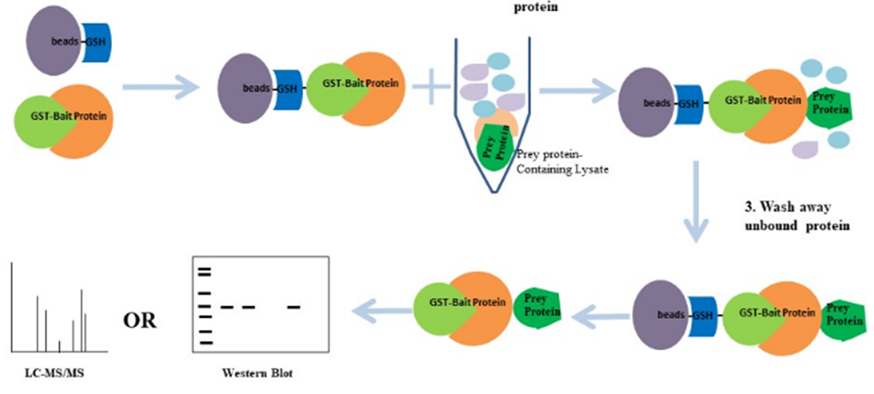
圖 GST Pull-down實驗流程示意圖
六. Pull-down結果解讀1、已知蛋白互作驗證
對于已知蛋白是否存在相互作用,通常利用Western blot進行檢測,設置GST+His-B組作為陰性對照;Input用于蛋白表達檢測,Pull-down分析互作結果分析。
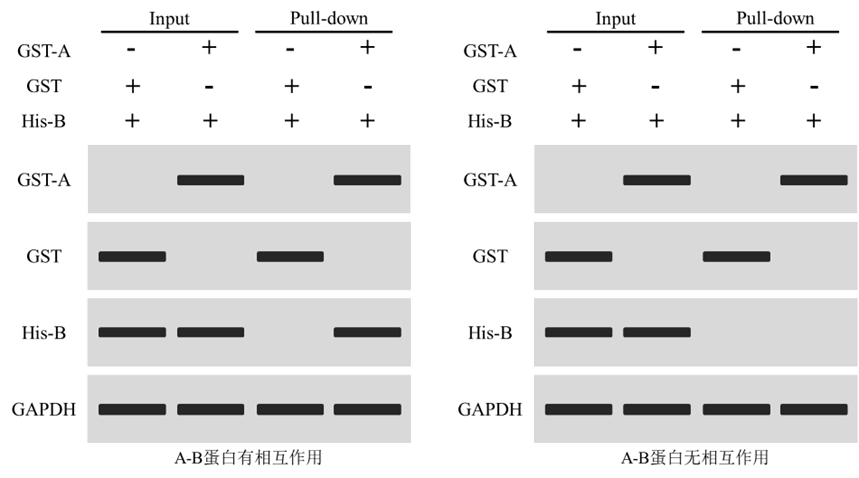
上圖為檢測蛋白A和蛋白B是否互作結果。結果顯示,Input和Pull-down中,GAPDH皆正常檢出,表明細胞樣本蛋白提取正常(若蛋白B也為純化蛋白,則無需檢測GAPDH表達);Input和Pull-down中,GST+His-B組中僅檢出GST目的條帶,GST-A+His-B組中僅檢出GST-A目的條帶,表明GST-A蛋白純化正常且無非特異性條帶;
左圖中,Input正常檢出His-B目的條帶,表明蛋白B表達正常;Pull-down中GST+His-B組未檢出條帶,表明GST不與His-B發生結合;GST-A+His-B組檢出His-B蛋白,表明GST-A可富集His-B,蛋白A和蛋白B存在互作;右圖中,GST-A+His-B組未檢出His-B蛋白,表明GST-A無法富集His-B,蛋白A和蛋白B不存在相互作用。
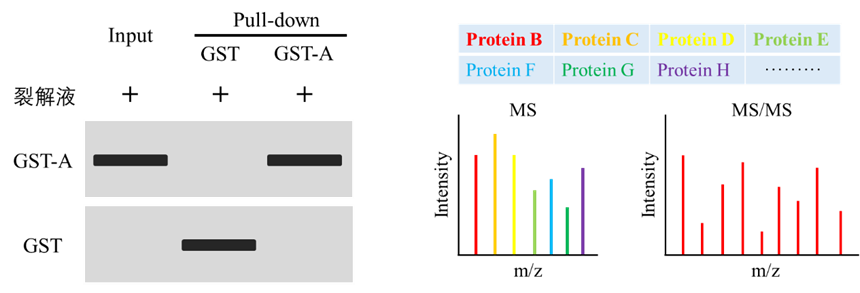
2、未知互作蛋白篩選
對于篩選與目的蛋白存在相互作用的潛在蛋白,通常利用質譜技術進行分析。首先利用Western blot技術對Pull down結果進行檢測,Western blot檢測包含Input組、GST組以及Pull-down組,其中Input組和GST組分別作為陽性對照和陰性對照,Pull-down則用于檢測GST-A是否正常存在;質譜分析時可將GST樣本作為陰性對照,排除假陽性信號。
七. Pull-down影響因素
在Pull-down實驗過程中,蛋白表達、純化、Pull-down實驗各個過程出現問題都會影響最終Pull-down結果,主要影響因素如下:
1、融合蛋白標簽選擇
不同蛋白標簽大小差別較大,部分大分子量標簽如GST、MBP以及NusA等可能會影響蛋白的正確折疊或者蛋白表達,因此可在實驗前利用生物信息學預測標簽是否影響蛋白構象或者采用X-射線晶體分析等手段加以驗證,保證實驗結果更加可信。
2、蛋白表達載體的選擇
不同蛋白表達系統質粒載體對于融合蛋白可溶性、蛋白表達誘導方式以及表達豐度存在差異,因此在進行蛋白表達純化時需選擇合適的表達質粒,確保融合蛋白能夠大量表達可溶性蛋白。例如pGEX載體通常用于GST融合蛋白表達。目前常用蛋白表達載體如下:
(1)pET系列:T7啟動子,使用His標簽,便于蛋白純化,并且蛋白表達量 高,但容易形成包涵體;
(2)pGEX系列:Tac啟動子,使用GST標簽,表達量高,促溶效果好,是目 前使用較為廣泛的表達載體,但GST標簽較大,可能影響蛋白構象;
(3)pMAL系列:Tac啟動子,使用MBP標簽,促溶效果極強,但MBP標簽 大,容易影響蛋白構象;
(4)pCold系列:CSPA啟動子,帶有低溫誘導原件,通常適用于溫度敏感蛋 白,蛋白表達量較低。
3、蛋白表達誘導條件
(1)誘導溫度
由于蛋白間存在較強的溫度依賴性疏水作用,溫度過高導致蛋白聚集并沉淀,容易形成包涵體。因此大部分蛋白表達表達需低溫誘導(16℃);但部分溫度敏感型表達載體如pBV220則需要較高溫度進行(30℃)蛋白表達誘導。因此在進行小量蛋白誘導表達時可設置高溫組和低溫度進行檢測,選擇適合的誘導溫度。
(2)誘導時間
蛋白表達過程中,通常選擇在菌體處于對數生長期(OD值一般為0.6-0.8)進行蛋白表達誘導。由于菌體此時生長速度快,因此可獲得大量可溶性蛋白。通常而言,誘導時間與誘導溫度成反比,誘導溫度越高,誘導時間越短;若為低溫誘導,則需相應延長表達誘導時間。在進行小量蛋白誘導表達時可設置不同誘導時間梯度,選擇適合的蛋白高表達誘導時間。
(3)誘導劑濃度
不同的蛋白表達載體需選擇不同誘導劑。以GST Pull-down實驗為例,目前常用表達載體為pGEX系列,所用誘導劑為IPTG。雖然IPTG不會被細菌代謝而保持穩定的濃度,但由于具有一定的細胞毒性,因此濃度過高會導致菌體活性差甚至死亡,進而影響蛋白表達和純化,例如產生大量錯誤折疊蛋白并形成包涵體。因此在實驗中通常設置不同濃度梯度,并且盡量選擇低濃度、長時間誘導表達的方式,以獲取足夠量的可溶性融合蛋白。常用蛋白表達誘導劑如下:
-
IPTG(異丙基硫代-β-D-半乳糖苷):最常用的誘導劑之一,通常用于大腸桿菌表達系統,主要通過與lac操縱子結合,解除阻遏蛋白對啟動子的抑制,啟動目的蛋白表達。
-
乳糖/乳糖類似物:與IPTG類似,在天然的lac系統中,乳糖或者其類似物可以通過與lac操縱子結合誘導目的基因表達。此類誘導劑通常適用于更加溫和或者更加自然條件下的蛋白表達。
-
抗生素:針對特定系統并選擇特定抗生素,如Tet-on/Tet-off系統選擇四環素或其衍生物,能夠通過與相應調控元件結合誘導目的基因表達,此類誘導劑通過特定濃度抗生素啟動或者關閉蛋白表達。
-
金屬離子:與抗生素誘導類似,某些金屬相應的表達系統中,如T7噬菌體啟動子系統結合金屬離子(Zn2+)能夠誘導目的蛋白的表達,此類誘導劑使用濃度需根據載體和細胞系的敏感性進行確定。
4、包涵體形成
在蛋白表達過程中,由于蛋白錯誤折疊并聚集形成包涵體時,導致Pull-down實驗失敗。可通過使用高濃度的尿酸和鹽酸胍使其變性解聚,隨后逐步去除變性劑并加入適當的緩沖液使蛋白重新折疊,恢復功能性構象,進行后續的pull-down實驗。也可通過降低誘導溫度及誘導劑濃度、引入分子伴侶共表達、換專用感受態等方式來解決。
5、核酸分子影響
對于RNA結合蛋白或者DNA結合蛋白,在存在核酸的情況下,會通過與核酸結合造成假陽性,因此在進行Pull-down實驗時需要加入核酸酶,去除核酸造成的假陽性結果。
八. Pull-down常見問題
1、Pull-down結果出現背景信號
背景雜帶信號主要源于非特異性結合。在GST-A富集靶蛋白階段可通過增加洗脫次數、更強的洗脫條件、使用BSA等抑制非特異性結合過程;在Western blot實驗時,則需嚴格按照實驗流程,參考前文《蛋白互作檢測之磁珠法Co-IP技術》,使用更加合適的抗體等方法減少非特異性結合。
2、Pull-down蛋白條帶模糊
出現蛋白條帶模糊的原因包括蛋白純度不夠或者蛋白降解導致。針對前者可適當增加蛋白洗脫過程中洗脫劑的濃度或者優化蛋白純化方法如在Ni親和層析時使用高鹽buffer;更換表達菌體,進行蛋白標簽聯用等手段解決蛋白純度不夠問題;針對蛋白降解問題,如是因為蛋白序列或者密碼子偏好性等原因,則可換用Rosett、OrigamiB等菌體進行蛋白表達。此外可在實驗中增加蛋白酶抑制劑的用量,保證實驗全程低溫進行等。
3、Pull-down結果與其他手段結果不一致
由于Pull-down實驗屬于體外水平,僅能驗證直接相互作用,因此對于某些間接互作蛋白無法有效檢出,而Co-IP技術用于檢測體內生理狀態下蛋白互作情況,可檢出間接互作蛋白。因此Pull-down結果可能存在與其他檢測結果不一致的情況,此時需增加檢測手段,進行相互佐證并分析具體互作類型。
九. Pull-down技術案例
1、GST Pull-down證實PHB2調控SHIP2與PHB1和PHB2的互作

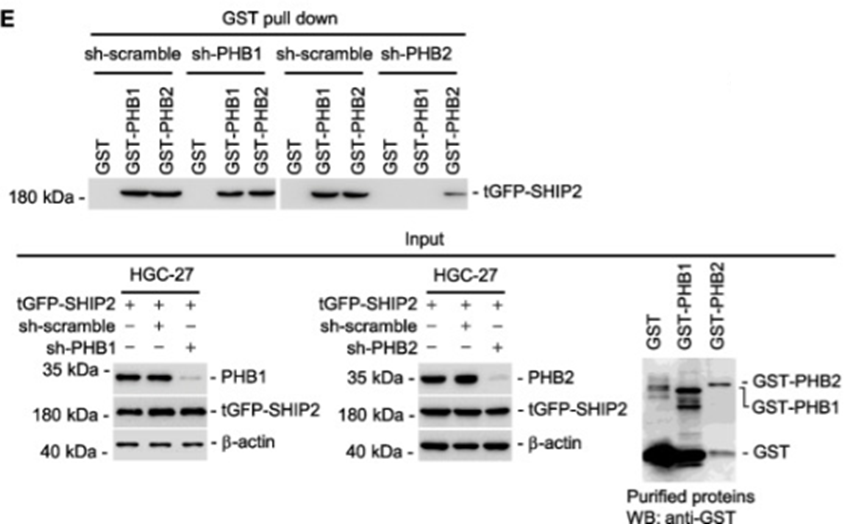
上圖Input結果顯示,內參蛋白β-actin表達正常,tGFP-SHIP2表達正常,GST-PHB1和GST-PHB2表達正常;GST Pull-down結果顯示,使用GST-PHB1或者GST-PHB2蛋白均可拉下t-GFP-SHIP2,表明SHIP2蛋白與PHB1或者PHB2均存在相互作用。使用sh-PHB1干擾PHB1的表達,對GST Pull-down結果無影響,使用shPHB2干擾PHB2的表達時,GST-PHB1與tGFP-SHIP2的互作消失,GST-PHB2與tGFP-SHIP2的互作減弱,表明SHIP2與PHB1或者PHB2的互作依賴于PHB2的表達。
2、蛋白直接相互作用研究

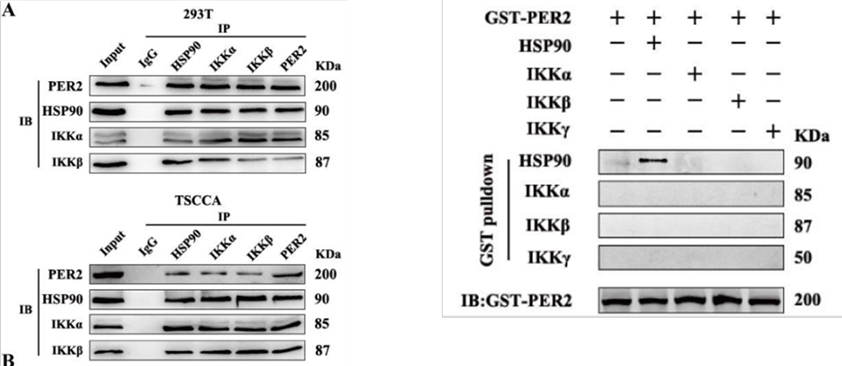
上圖中,Co-IP結果顯示(左圖),在293T和TSCCA細胞中,利用PER2進行IP富集后,可檢測到HSP90、IKKα、IKKβ目的蛋白,表明PER2蛋白與HSP90、IKKα、IKKβ蛋白形成復合體;GST Pull-down結果顯示(右圖),使用GST-PER2進行富集后,金科檢測到HSP90目的蛋白,表明PER2僅與HSP90為直接互作,與IKKα、IKKβ蛋白為間接互作。
- 上一篇:沒有啦
- 下一篇:蛋白互作檢測之磁珠法Co-IP技術 2025/5/18

