自動(dòng)化蛋白質(zhì)組樣品制備:高通量和定量質(zhì)譜分析的關(guān)鍵
原名: Automated proteomic sample preparation: The key component for high throughput and quantitative mass spectrometry analysis
譯名:自動(dòng)化蛋白質(zhì)組樣品制備:高通量和定量質(zhì)譜分析的關(guān)鍵
期刊:Mass Spectrometry Reviews
IF:10.946
發(fā)表時(shí)間:2021.10
通訊作者:Jennifer E. VanEyk
1.引言
液相色譜質(zhì)譜(LC -MS)儀器的改進(jìn)和生物信息學(xué)的發(fā)展,促進(jìn)了基于質(zhì)譜的蛋白質(zhì)和肽段定量方法的發(fā)展。質(zhì)譜作為基礎(chǔ)的臨床研究工具,單針可定量1000個(gè)蛋白質(zhì)。血液或尿液等生物液體是一種很容易獲得的樣本,通過(guò)這些樣本可深入了解患者的健康或疾病狀況。質(zhì)譜可用于識(shí)別組織或生物液體中的生物標(biāo)志物,進(jìn)行診斷、分期、監(jiān)測(cè)或預(yù)測(cè)疾病的病理或臨床結(jié)果。
開(kāi)發(fā)用于臨床的生物標(biāo)志物需要兩個(gè)階段:發(fā)現(xiàn)和驗(yàn)證。發(fā)現(xiàn)階段的特點(diǎn)是對(duì)患者樣本進(jìn)行全面分析,以開(kāi)發(fā)候選生物標(biāo)志物。這通常使用數(shù)據(jù)依賴(lài)型采集方法(DDA)或非數(shù)據(jù)依賴(lài)型采集(DIA)(下文討論)來(lái)完成。在這個(gè)階段,需要可信的定量信息。當(dāng)一個(gè)或多個(gè)候選標(biāo)志物已經(jīng)確定,標(biāo)志物需要使用更大的患者隊(duì)列進(jìn)行驗(yàn)證,以建立在臨床應(yīng)用中特異性和敏感性的標(biāo)志物。這種方法利用了多種/選擇性反應(yīng)監(jiān)測(cè)(M/SRM)、平行反應(yīng)監(jiān)測(cè)(PRM)或確定定量質(zhì)譜(SQ - MS)等有靶向定量質(zhì)譜方法(下文討論)。這些方法為復(fù)雜的生物樣品提供了全面和準(zhǔn)確的肽段定量信息。
無(wú)論基于發(fā)現(xiàn)蛋白質(zhì)組學(xué)或靶向蛋白質(zhì)組學(xué),質(zhì)譜分析前基本步驟是樣品制備。在質(zhì)譜分析之前,蛋白質(zhì)樣品經(jīng)過(guò)一系列步驟被消化成多肽。然而,重復(fù)性、時(shí)間和成本仍然是大規(guī)模和高通量質(zhì)譜樣品處理的障礙。為了解決這個(gè)問(wèn)題,開(kāi)發(fā)快速和準(zhǔn)確的蛋白樣品制備工作流程是必要的,從而提高檢測(cè)通量,促進(jìn)從生物標(biāo)志物的發(fā)現(xiàn)到臨床應(yīng)用。改進(jìn)樣品制備的一項(xiàng)新型創(chuàng)新方法是利用自動(dòng)化操作工作站,可以準(zhǔn)確可靠地完成樣品制備中復(fù)雜的流程。在接下來(lái)的章節(jié)中,我們概述了在質(zhì)譜樣品制備方案中自動(dòng)化步驟的優(yōu)化,并描述自動(dòng)化在發(fā)現(xiàn)、驗(yàn)證和臨床蛋白質(zhì)組學(xué)工作流程中是如何實(shí)現(xiàn)的。
2.LC-MS樣品制備的基本步驟和優(yōu)化
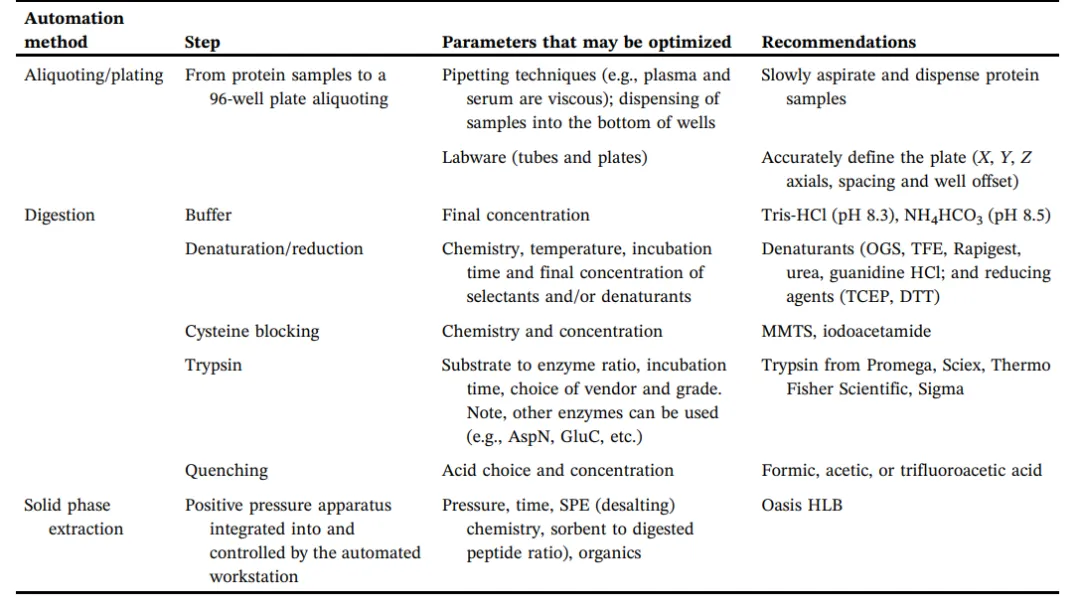
蛋白質(zhì)組樣品制備過(guò)程中,有幾個(gè)關(guān)鍵的步驟,根據(jù)實(shí)驗(yàn)可能需要進(jìn)一步優(yōu)化這些步驟。步驟包括(1)蛋白質(zhì)濃度測(cè)量;(2)蛋白質(zhì)變性;(3)還原;(4)烷基化;(5)消化,如胰蛋白酶進(jìn)行消化;(6)終止消化;(7)通過(guò)固相萃取方法脫鹽,目的是以去除干擾成分(圖1)。樣品制備過(guò)程中的每個(gè)步驟的優(yōu)化對(duì)于獲得一個(gè)可靠的、可重復(fù)的定量蛋白質(zhì)組學(xué)流程至關(guān)重要。臨床生物標(biāo)志物驗(yàn)證的精確度需要滿(mǎn)足單日內(nèi)和單日間的CV值小于20%。表1列出了實(shí)現(xiàn)預(yù)期性能和可重復(fù)性時(shí)所需的參數(shù)建議。變性劑、胰蛋白酶(或其他酶)與底物比率、緩沖液組成、孵育時(shí)間、溫度等特性都應(yīng)進(jìn)行評(píng)估,以了解這些參數(shù)對(duì)質(zhì)譜的靈敏度和蛋白質(zhì)組的可靠性的影響。然后對(duì)這些參數(shù)進(jìn)行手動(dòng)化和自動(dòng)化評(píng)估。使用自動(dòng)化工作站,可以更好的實(shí)現(xiàn)對(duì)液體處理、混合、孵育時(shí)間和溫度的控制。
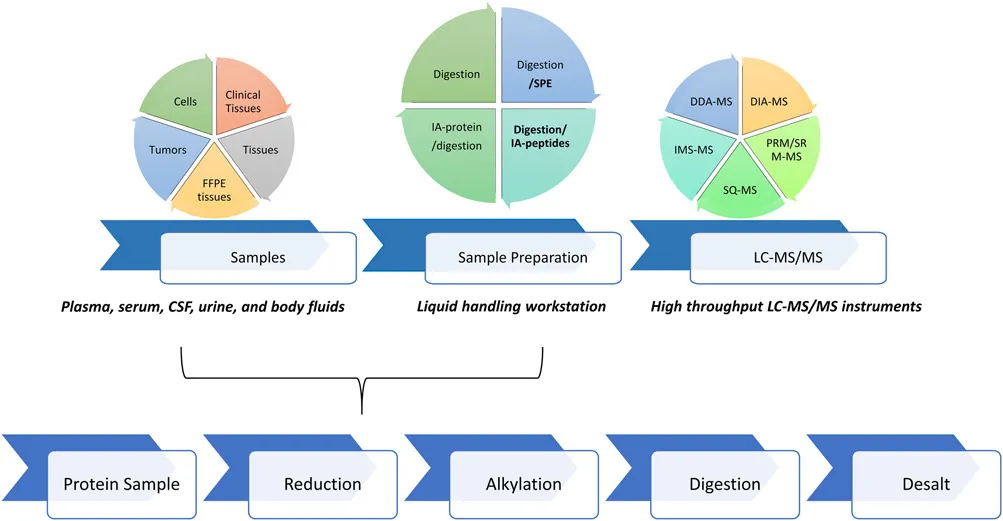
2.1 蛋白質(zhì)變性
蛋白質(zhì)變性是消化樣品的關(guān)鍵步驟。蛋白質(zhì)二級(jí)結(jié)構(gòu)打開(kāi)有利于烷基化和酶切。變性有利于提高蛋白水解效率,最終提高樣品制備的重復(fù)性。在蛋白質(zhì)提取過(guò)程中,去垢劑被廣泛使用,尤其是十二烷基硫酸鈉(SDS)。然而,在隨后的LC - MS/MS分析中去垢劑可能存在嚴(yán)重的干擾問(wèn)題。其他的試劑,如尿素或胍-鹽酸,也可以用來(lái)使蛋白質(zhì)變性,但也會(huì)干擾質(zhì)譜分析,需要在蛋白質(zhì)水解后從樣品中移除。在酸性條件下不穩(wěn)定的去垢劑(ALS)兼容質(zhì)譜,如Rapigest SF。Rapigest SF是SDS類(lèi)似物,是裂解蛋白質(zhì)的表面活性劑,在酸性條件下可以被分解,分解后不干擾質(zhì)譜鑒定。去垢劑的成本高,因此對(duì)于大規(guī)模的隊(duì)列質(zhì)譜鑒定成本更高,但是一些ALSs高效實(shí)用。
Proc等人的研究發(fā)現(xiàn)50%(v/v)2-2-2三氟乙醇(TFE)可以用于血漿蛋白質(zhì)提取,結(jié)果與SDS提取類(lèi)似。許多研究表明TFE對(duì)蛋白質(zhì)結(jié)構(gòu)有影響,能溶解球狀蛋白的疏水核心使膜蛋白變性。此外,Reiersen等人證明TFE濃度≥30%(v/v)和溫度為58.6℃是最優(yōu)的變性條件。TFE可以用于血液、血漿、尿液、組織和細(xì)胞的蛋白質(zhì)提取。TFE的廣泛應(yīng)用,儀器兼容性以及揮發(fā)性的特點(diǎn)使其在樣品制備中具有顯著的優(yōu)勢(shì)。
2.2 還原和烷基化
變性后,蛋白質(zhì)被進(jìn)一步還原并烷基化,打破維持蛋白質(zhì)三級(jí)結(jié)構(gòu)的二硫鍵,并防止游離半胱氨酸再次形成二硫鍵。打開(kāi)半胱氨酸的二硫鍵提高蛋白質(zhì)的酶切效率和降低數(shù)據(jù)搜庫(kù)的難度。還原反應(yīng)通常在較高的溫度下進(jìn)行,還原劑主要包括二硫蘇糖醇(DTT)、2-巰基乙醇(2-ME)、三(2-羧乙基)膦(TCEP)或三(3-羥丙基)膦(THPP)。烷基化使用碘乙酰胺(IAA)、丙烯酰胺(AA)、甲基甲硫磺酸鹽(MMTS)、N-乙基馬來(lái)酰亞胺(N -EM)或4-乙烯基吡啶(4-VP)實(shí)現(xiàn)。這兩類(lèi)試劑參與樣品制備過(guò)程中的還原烷基化過(guò)程,每個(gè)反應(yīng)都需要評(píng)估其完整性或副反應(yīng),副反應(yīng)會(huì)改變鑒定的肽段原有的質(zhì)量。Suttapitugsakul等人對(duì)還原和烷基化條件的綜合評(píng)估。
2.3 酶解
自下而上的蛋白質(zhì)組學(xué)需要將蛋白進(jìn)行酶切然后進(jìn)行數(shù)據(jù)庫(kù)搜索。胰蛋白酶由于酶切的特異性(在賴(lài)氨酸和精氨酸殘基之后)和較高的酶活,因此是蛋白質(zhì)組學(xué)實(shí)驗(yàn)中最常用的蛋白酶。用胰蛋白酶消化產(chǎn)生大小為500-5000Da的肽段且有好的蛋白覆蓋率。其他幾種蛋白酶都有各自的特異性,如胰凝乳蛋白酶、Glu-C、Asp-N或蛋白酶K。蛋白酶可以單獨(dú)使用或與胰蛋白酶聯(lián)合使用增加酶切位點(diǎn),提高序列覆蓋度。對(duì)于任何蛋白質(zhì)水解,有效的消化取決于優(yōu)化酶與蛋白質(zhì)的比例、溫度和溫度。
之前的研究表明,蛋白質(zhì)酶切步驟是LC-MS分析中不穩(wěn)定性的主要來(lái)源。不穩(wěn)定性的主要驅(qū)動(dòng)因素之一是大多數(shù)蛋白質(zhì)組固有的復(fù)雜性。人類(lèi)蛋白質(zhì)組來(lái)源于2萬(wàn)多個(gè)基因,同一個(gè)基因產(chǎn)生多個(gè)異構(gòu)體以及多翻譯后修飾(PTMs)等。蛋白質(zhì)異構(gòu)體在時(shí)間和空間上調(diào)控個(gè)體的生理或病理狀態(tài)(圖2)。蛋白質(zhì)濃度有大的動(dòng)態(tài)范圍,在一個(gè)樣品中,高豐度的蛋白比低豐度蛋白高出10個(gè)數(shù)量級(jí)。為了獲得最優(yōu)的人體血漿酶切效率,研究14種不同的蛋白質(zhì)變性條件。不同基質(zhì)(血漿、血清、腦脊液[CSF]和其他蛋白質(zhì)組樣品)的蛋白裂解是復(fù)雜的,每個(gè)蛋白都有各自的三級(jí)、四級(jí)結(jié)構(gòu)和酶切位點(diǎn)。檢測(cè)外源添加細(xì)菌蛋白β-半乳糖苷酶(β‐gal)發(fā)現(xiàn)171份人類(lèi)血漿樣本處理的變異系數(shù)(CV)在18%-25%。使用兩種蛋白質(zhì)(外源性β-gal和內(nèi)源性人血清白蛋白)作為自動(dòng)消化監(jiān)測(cè)的代表性分析物,白蛋白和β-gal的峰值面積比(天然/穩(wěn)定同位素標(biāo)記[SIL]肽信號(hào))在優(yōu)化前分別為30%CV和20%CV。優(yōu)化自動(dòng)化工作站后,內(nèi)源性人血清白蛋白和外源添加的β-gal蛋白的CV分別達(dá)到3%和4%-8%(圖3)。
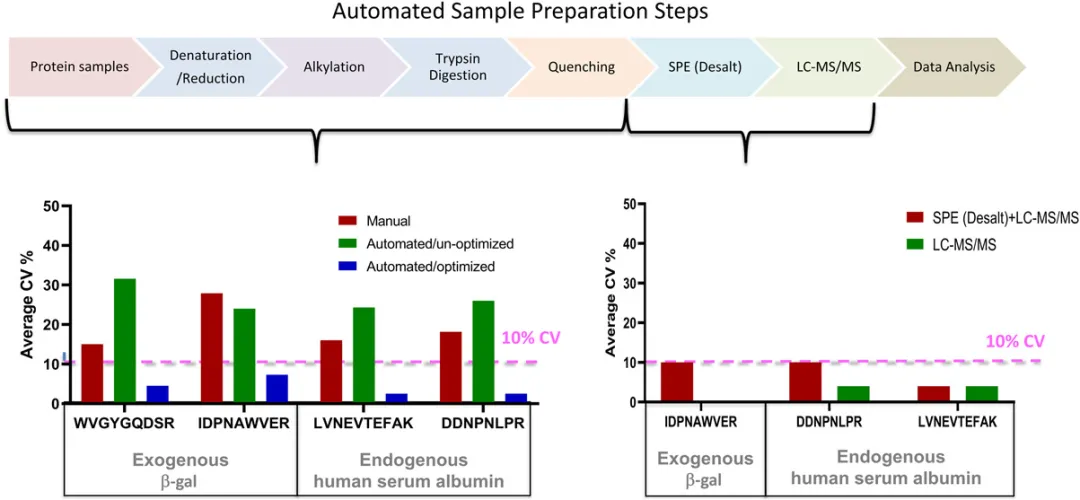
左圖為三種不同消化條件的CV%如圖所示:手動(dòng)消化(紅色)、未優(yōu)化的自動(dòng)消化(綠色)和優(yōu)化的自動(dòng)消化(藍(lán)色)。重現(xiàn)性用面積比(輕標(biāo)/重標(biāo)SIL)和CV值進(jìn)行評(píng)估,CV值是通過(guò)β-gal酶切肽段加入到健康的人血漿來(lái)評(píng)估(4-8個(gè)重復(fù))。血漿樣品變性、還原、烷基化并用胰蛋白酶消化。平均面積比CV% β-gal和輕標(biāo)的峰面積(輕標(biāo)/重標(biāo)SIL)計(jì)算人血清白蛋白。MRM數(shù)據(jù)采用6500QTRAP采集。右圖顯示自動(dòng)固相萃取(24孔)的CV%。β-gal和人血清白蛋白SIL多肽加入酶切后的健康人的血漿樣品中,用整合i7自動(dòng)控制裝置工作站的正壓裝置脫鹽。脫鹽后SIL重標(biāo)肽信號(hào)計(jì)算CV%。MRM數(shù)據(jù)同樣由LC‐MS獲得。CV %是從7次重復(fù)注射中計(jì)算出來(lái)。SIL,穩(wěn)定同位素標(biāo)記。
2.4.終止
消化后,在酸性條件下終止反應(yīng),酸化的肽段進(jìn)行脫鹽。常用的幾種揮發(fā)性酸:甲酸、乙酸或三氟乙酸。在18O標(biāo)記的情況下,酶切終止有利于防止胰蛋白酶介導(dǎo)的重標(biāo)反向交換。
2.5 脫鹽
用高分辨率質(zhì)譜儀(如Orbitrap、TripleTOF或TimsTOF)分析肽段需要進(jìn)行脫鹽,實(shí)現(xiàn)去除污染物并濃縮肽段的目的。通常使用C18樹(shù)脂特異性地結(jié)合多肽去除污染物。固相萃取可以通過(guò)手動(dòng)真空提取或正壓裝置來(lái)實(shí)現(xiàn)(手動(dòng)或自動(dòng))。手動(dòng)調(diào)解真空影響重現(xiàn)性,建議使用正壓裝置。在自動(dòng)化的工作站上整合正壓除鹽裝置。采用集成的自動(dòng)化正壓裝置,壓力由氮?dú)庹{(diào)節(jié),流速和時(shí)間根據(jù)樣品和溶劑類(lèi)型預(yù)先編程,從而實(shí)現(xiàn)回收產(chǎn)物的均一性和可重復(fù)性。
最近出現(xiàn)了一些創(chuàng)新步驟,將樣品制備步驟整合到一個(gè)獨(dú)立的柱或槍尖上。S-trap利用多孔材料捕獲變性的蛋白質(zhì)溶液,去除污染物,對(duì)蛋白質(zhì)進(jìn)行還原、烷基化和消化。這種方法在樣品制備過(guò)程中有效的去除污染物和表面活性劑。Chen等人提出并擴(kuò)展了類(lèi)似的方法,集成的旋轉(zhuǎn)槍尖蛋白質(zhì)組學(xué)技術(shù)(SISPROT)利用強(qiáng)陽(yáng)離子交換珠和C18樹(shù)脂,實(shí)現(xiàn)樣品消化等步驟,包括最終脫鹽完全整合到單個(gè)槍尖上,從而實(shí)現(xiàn)快速,高靈敏度,樣品損失小的優(yōu)點(diǎn)。該方法與一些翻譯后修飾的富集兼容。在自動(dòng)化的流程中,樣品制備的一體化和簡(jiǎn)化很重要。
開(kāi)發(fā)自動(dòng)化流程進(jìn)一步考慮是試劑的選擇,試劑應(yīng)該具備可分裝的特點(diǎn)從而減少試劑的批量化效應(yīng)。在96孔板里,外源蛋白β-半乳糖可用于質(zhì)量控制監(jiān)測(cè)自動(dòng)蛋白質(zhì)組學(xué)樣品制備工作流程的再現(xiàn)性和準(zhǔn)確性。在還原和烷基化反應(yīng)之前加入β-半乳糖蛋白及其相應(yīng)SIL肽標(biāo)準(zhǔn)的混合物。建立優(yōu)化的自動(dòng)化工作流程,評(píng)估幾天內(nèi)的重現(xiàn)性很重要。對(duì)于標(biāo)準(zhǔn)化自動(dòng)化工作流程,同時(shí)需要在多個(gè)實(shí)驗(yàn)室進(jìn)行重復(fù)。
3.定量質(zhì)譜法
樣品準(zhǔn)備完成后,使用高性能質(zhì)譜技術(shù)分析樣品進(jìn)行疾病生物標(biāo)志物的發(fā)現(xiàn)或驗(yàn)證研究。基于發(fā)現(xiàn)蛋白質(zhì)組學(xué),通常使用數(shù)據(jù)依賴(lài)型采集(DDA-MS)或非數(shù)據(jù)依賴(lài)型采集(DIA-MS)方法提供生物樣本定量評(píng)估。在DDA-MS中,所有前體離子在一級(jí)掃描期間被掃描(MS1),然后選擇一些離子進(jìn)行碎裂,產(chǎn)生一系列串聯(lián)質(zhì)譜(MS/MS或MS2)。所有的譜圖在數(shù)據(jù)庫(kù)中進(jìn)行搜索,匹配到肽段和蛋白質(zhì)。DDA是針對(duì)前N個(gè)母離子(設(shè)定特定數(shù)量的前體離子且信號(hào)高于“噪聲”)進(jìn)行采樣,碎裂產(chǎn)生二級(jí)譜圖,所以影響低豐度肽和蛋白質(zhì)的定量和定性。
在DIA-MS中,定義的質(zhì)荷比(m/z)窗口內(nèi)所有前體離子都可能碎裂。碎片離子在特定的隔離窗口中積累。由于所有檢測(cè)到的前體離子都可以被碎裂,所以DIA-MS的優(yōu)勢(shì)在于能夠準(zhǔn)確定量,而不受DDA-MS前體離子碎裂數(shù)量的限制。DIA-MS方法需要產(chǎn)生高分辨率二級(jí)譜圖的質(zhì)譜儀。
除了發(fā)現(xiàn)標(biāo)志物,還需要在大量患者樣本中有針對(duì)性的驗(yàn)證。目前,驗(yàn)證的方法有多反應(yīng)監(jiān)測(cè)質(zhì)譜(MRM-MS),也被稱(chēng)為選擇性反應(yīng)監(jiān)測(cè)質(zhì)譜(SRM-MS),平行反應(yīng)監(jiān)測(cè)質(zhì)譜(PRM-MS),以及Sure-Quant質(zhì)譜法(SQ-MS)。Sure-Quant質(zhì)譜法(SQ-MS)可對(duì)體液、穿刺樣本或培養(yǎng)細(xì)胞的肽段中特定的肽段進(jìn)行精確定量。SRM-MS利用高重復(fù)性三重四極桿(QqQ)質(zhì)譜儀選擇肽段進(jìn)行定量分析。SRM-MS的優(yōu)勢(shì)在于肽/蛋白定量的選擇性、敏感性和多重性。PRM-MS是一種類(lèi)似SRM的靶向方法,需要高分辨率和高質(zhì)量精度(HR/AM)的質(zhì)譜儀進(jìn)行二級(jí)譜圖采集。多肽和蛋白質(zhì)定量具有高度的選擇性和特異性。SQ-MS是最近開(kāi)發(fā)的一種利用HR/AM Orbitrap質(zhì)譜儀靶向采集方法。用動(dòng)態(tài)變化的質(zhì)譜參數(shù)監(jiān)測(cè)樣品中的參考內(nèi)標(biāo)。該方法提高了內(nèi)源性肽定量的數(shù)據(jù)質(zhì)量并且可以實(shí)現(xiàn)大量靶點(diǎn)肽段的定量。
4. 實(shí)現(xiàn)自動(dòng)蛋白質(zhì)組學(xué)樣品制備
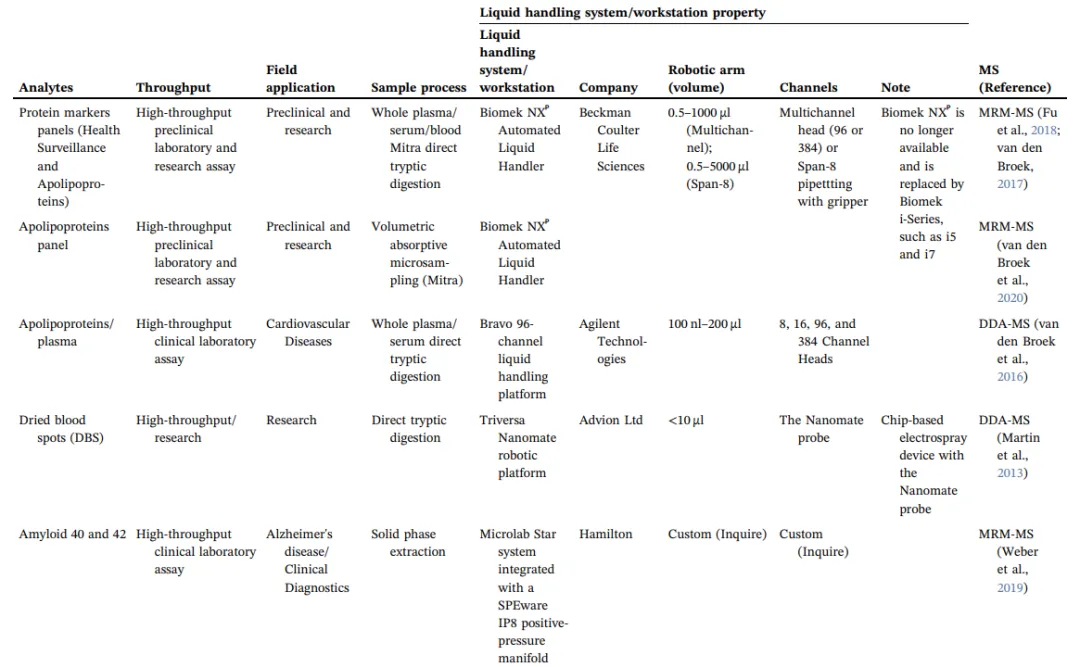
蛋白質(zhì)組學(xué)實(shí)驗(yàn)的成功與否很大程度上取決于樣品制備的速度和質(zhì)量。在樣品制備流程中通過(guò)自動(dòng)化的工作站提高樣品通量和準(zhǔn)確度。自動(dòng)化工作站需要以下功能:(1)在精確的時(shí)間里控制液體轉(zhuǎn)移,(2)從試劑瓶/盤(pán)中轉(zhuǎn)移液體到酶解盤(pán),(3)96/364針和/或8跨度的頭,(4)移動(dòng)酶解盤(pán),(5)溫度和時(shí)間控制的容器可以震動(dòng),(6)一個(gè)獨(dú)立的平板搖床,用作攪拌機(jī)。這些特點(diǎn)使人類(lèi)的雙手從重復(fù)和勞動(dòng)密集的步驟中解放出來(lái),并提高大量樣品的準(zhǔn)確性和重現(xiàn)性。在文獻(xiàn)中,越來(lái)越多的例子表明,在高通量臨床、病理、制藥和研究領(lǐng)域利用自動(dòng)化工作站進(jìn)行蛋白質(zhì)組學(xué)樣品制備(表2)。下面的部分描述了幾個(gè)關(guān)鍵的研究,以及自動(dòng)化工作流程的性能。
4.1 直接消化‐質(zhì)譜
生物液體,如血漿、血清、CSF、尿液以及血液,包括Whatman收集紙收集的干的血液或體積吸收微采樣(VAMS)收集到的干的血液,這些生物液體是復(fù)雜的基質(zhì),有豐富的蛋白質(zhì)組信息。在臨床前和臨床研究中,有幾項(xiàng)研究利用自動(dòng)化工作站開(kāi)發(fā)了蛋白質(zhì)消化和定量質(zhì)譜分析的自動(dòng)化工作流程(表2)。直接消化是樣品制備最簡(jiǎn)單的形式,不需要從細(xì)胞或組織中提取特定的物質(zhì)或特定的富集/去除步驟。例如,Biomek NX?(貝克曼庫(kù)爾特有限公司)的自動(dòng)化工作流程直從Mitra(一種體積吸收微采樣設(shè)備)消化干燥血液,Mitra結(jié)合高流速LC和靈敏的三重四級(jí)桿質(zhì)譜儀,利用MRM方法實(shí)現(xiàn)高精度地定量高豐度蛋白(CV<20%)。在另一項(xiàng)研究中,Bravo(安捷倫)96通道液體處理器用于處理干血滴(DBS),結(jié)合高流速LC-MS定量肽段,如載脂蛋白A-I,B, C-II C-III和E,利用MRM的技術(shù)實(shí)現(xiàn)CV<6%。另一項(xiàng)研究使用Tecan Freedom液體處理自動(dòng)化工作站對(duì)來(lái)自DBS樣品的97種血液蛋白進(jìn)行定量,每條肽的樣品內(nèi)重復(fù)和樣品間重復(fù)CV<12%(包括MS CV)。
4.2 固相萃取
這個(gè)工作流程已經(jīng)在臨床實(shí)驗(yàn)室實(shí)現(xiàn),Quest Diagnostics報(bào)告了一種高通量MS分析確定CSF中β-淀粉樣蛋白中1-42(A42)與β-淀粉樣蛋白1-40 (A40)的比例,診斷和區(qū)分阿爾茨海默病患者和健康對(duì)照者。CSF胰蛋白酶消化后采用基于漢密爾頓自動(dòng)化液體處理程序的固相萃取自動(dòng)化工作流程完成。我們團(tuán)隊(duì)已經(jīng)使用i7混合液體處理工作站的正壓裝置脫鹽。液體處理%CV為6%左右(包括脫鹽步驟時(shí),總%CV為~10%;未脫鹽總%CV約為4%)(圖3右下圖)。
4.3 質(zhì)量控制
單克隆抗體(mABs)治療已迅速成為各種疾病治療的重要治療手段,包括癌癥、慢性炎癥和病理性感染。最近,美國(guó)食品和藥物管理局(FDA)已批準(zhǔn)使用單克隆抗體治療COVID-19。對(duì)于生物制藥行業(yè)來(lái)說(shuō),監(jiān)測(cè)mAB的質(zhì)量控制至關(guān)重要,包括重組序列驗(yàn)證。實(shí)驗(yàn)室使用自動(dòng)樣品制備方法對(duì)單抗質(zhì)量控制進(jìn)行研究,該方法使用KingFisher液體處理工作站(賽默飛)通過(guò)質(zhì)譜方法匹配mAB多肽。該團(tuán)隊(duì)還使用相同的自動(dòng)化流程進(jìn)行了實(shí)驗(yàn)室間研究,以證明mAB產(chǎn)品質(zhì)量控制的一致性。
4.4 免疫親和富集和去除
血液蛋白質(zhì)組(和由此產(chǎn)生的血漿和血清亞蛋白質(zhì)組)的蛋白質(zhì)濃度范圍跨度大;~1010個(gè)蛋白質(zhì),濃度跨度從mg/ml到pg/ml。高豐度的蛋白抑制了低豐度蛋白的檢測(cè)。為了提高低峰度蛋白的靈敏度,免疫親和(IA)方法成功地應(yīng)用于自動(dòng)樣品制備。例如,Lassman等人使用特異性抗體富集低豐度的血漿膽甾醇酯轉(zhuǎn)移蛋白(CEPT)和Kexin樣前轉(zhuǎn)化酶枯草桿菌蛋白酶家族的第9個(gè)成員(PSCK9),使用優(yōu)化的自動(dòng)化IA程序(Freedom EVO, Tecan Trading)在不到3周的時(shí)間內(nèi)對(duì)1400份血漿樣本分析,實(shí)現(xiàn)樣品內(nèi)和樣品間的CV低于15%。
在免疫捕獲工作流程中,使用穩(wěn)定同位素標(biāo)準(zhǔn)和抗肽抗體捕獲(SISCAPA或免疫M(jìn)RM [iMRM])。進(jìn)行蛋白水解,捕獲帶有特異性抗體的肽段,通過(guò)質(zhì)譜進(jìn)行檢測(cè)和定量,iMRM測(cè)定臨床蛋白(>10分析物),如胱抑素C, C反應(yīng)蛋白,載脂蛋白E,載脂蛋白CIII和其他蛋白質(zhì)。血漿、血清和DBSs都可以用iMRM分析。多個(gè)自動(dòng)化工作站和平臺(tái)成功使用iMRM方法分析血漿生物標(biāo)志物,如Bravo自動(dòng)液體處理器(安捷倫),KingFisher磁粒子處理器(賽默飛),和漢密爾頓液體處理工作站(漢密爾頓)。這些液體處理工作站表明自動(dòng)化可以實(shí)現(xiàn)快速胰蛋白酶消化和免疫捕獲且單日內(nèi)和單日間的CV值均小于10%。
此外,iMRM抗肽抗體捕獲的一個(gè)優(yōu)點(diǎn)是酶切后暴露了不易接觸的表位。因此,iMRM可以在降低干擾的同時(shí)對(duì)臨床上血漿生物標(biāo)志物進(jìn)行定量。例如,甲狀腺球蛋白,循環(huán)腫瘤標(biāo)記物作為標(biāo)志物評(píng)估甲狀腺癌治療有效性,抗甲狀腺球蛋白自動(dòng)化抗體的缺失阻礙抗原決定簇鑒定假陰性結(jié)果。因此,開(kāi)發(fā)了一種自動(dòng)iMRM分析樣品制備流程來(lái)測(cè)量特定的甲狀腺球蛋白酶切后肽段。血漿蛋白經(jīng)胰蛋白酶消化后,采用自動(dòng)液體處理工作站(來(lái)自Eppendorf的epMotion)利用特異性抗體選擇性富集甲狀腺球蛋白特異性肽。富集后,用質(zhì)譜檢測(cè)內(nèi)源性甲狀腺球蛋白肽和標(biāo)肽,該方法能夠滿(mǎn)足臨床診斷所需的標(biāo)準(zhǔn)(CV < 20%)。
4.5 從細(xì)胞或組織中提取蛋白質(zhì)
與體液樣品處理相比,細(xì)胞、腫瘤或組織的蛋白水解消化的自動(dòng)化工作站需要額外的處理步驟。主要步驟包括組織或腫瘤破碎、細(xì)胞裂解、DNA剪切和蛋白質(zhì)提取、蛋白質(zhì)變性和消化步驟。最近,Müller等人開(kāi)發(fā)了一種方法,整合了自適應(yīng)聚焦聲學(xué)技術(shù)(AFA)和單點(diǎn)固相增強(qiáng)樣品制備(SP3,磁珠參考http://www.posuichina.com/Product/1736805216.html)在液體處理工作站上,用96孔板自動(dòng)處理組織裂解物。AFA超聲是一種先進(jìn)的聲學(xué)技術(shù),可以通過(guò)96孔板聚焦超聲對(duì)樣品進(jìn)行機(jī)械加工。SP3利用磁珠在有機(jī)溶劑(>50% ACN或EtOH)下促進(jìn)蛋白質(zhì)結(jié)合到珠子上的原理,再清洗磁珠去除污染物和去垢劑。工作流程實(shí)現(xiàn)全程自動(dòng)化細(xì)胞或組織樣品制備。最近報(bào)道的SP2工作流程(一種羧酸修飾順磁粒子的替代適應(yīng)性,利用液體處理程序(epMotion工作站,Eppendorf)進(jìn)行肽分離)可以有效去除污染物(洗滌劑和鹽)以及在質(zhì)譜鑒定前除鹽步驟(Waas等人,2019)。
4.6 COVID-19
COVID-19大流行體現(xiàn)將自動(dòng)樣本制備應(yīng)用到臨床實(shí)驗(yàn)室的必要性和緊迫性。大流行加速了臨床實(shí)驗(yàn)室對(duì)快速、準(zhǔn)確的自動(dòng)RNA檢測(cè)的需求。最近,發(fā)表了一些使用質(zhì)譜技術(shù)在臨床實(shí)驗(yàn)室進(jìn)行COVID-19相關(guān)篩查的報(bào)告。Cardozo等人開(kāi)發(fā)了一種自動(dòng)化制備樣品的方法并結(jié)合高通量靶向LC-MS/MS方法,檢測(cè)鼻和咽拭子中的SARS-Cov-2核蛋白肽。96個(gè)樣品的自動(dòng)酶解可以在4小時(shí)內(nèi)完成,LC/MS每10分鐘運(yùn)行4個(gè)樣品,每天可分析500個(gè)樣品。另一項(xiàng)研究利用PRM-MS對(duì)COVID-19刺突糖蛋白和核蛋白進(jìn)行檢測(cè),通過(guò)基于免疫親和的富集和溶液酶解的自動(dòng)化樣品制備。采用PRM-MS的采集模式進(jìn)行采集,檢測(cè)COVID - 19刺突糖蛋白和核蛋白。
5.臨床蛋白質(zhì)組學(xué)中的自動(dòng)化-未來(lái)展望
除了蛋白質(zhì)酶切自動(dòng)化,樣品制備的其他步驟自動(dòng)化也有優(yōu)點(diǎn)。例如,自動(dòng)收集樣品(條形碼和驗(yàn)證)進(jìn)行分塊、存儲(chǔ)和存檔,簡(jiǎn)化大型臨床隊(duì)列的管理。運(yùn)送和裝載樣品到樣品制備工作站的自動(dòng)化消除許多耗時(shí)和容易出錯(cuò)的步驟。全自動(dòng)化的發(fā)展將包括高質(zhì)量、預(yù)先包裝的、即用型的試劑的標(biāo)準(zhǔn)化。自動(dòng)化技術(shù)、液體處理、質(zhì)譜分析、數(shù)據(jù)處理和出報(bào)告整個(gè)流程縮短時(shí)間和成本,同時(shí)提高后續(xù)分析的可靠性和精度。磁珠法在蛋白質(zhì)組學(xué)樣品前處理上具有廣泛用途(如SP3磁珠、蛋白冠磁珠等。)
質(zhì)譜技術(shù)的快速發(fā)展與各種自動(dòng)化樣品制備工作流程相結(jié)合,將在常規(guī)臨床實(shí)驗(yàn)室中變得普遍。高分辨率、高精確的質(zhì)譜儀器有利于多個(gè)樣本的分析。目前,自動(dòng)樣品制備方法可用于發(fā)現(xiàn)蛋白質(zhì)組學(xué)(DDA-MS,DIA-MS)和靶向蛋白質(zhì)組學(xué)(PRM-MS;MRM/SRM-MS, SQ-MS)。然而,自動(dòng)化工具和工作流程需要靈活應(yīng)對(duì)新的質(zhì)譜方法。結(jié)合自動(dòng)化樣品制備和高通量、高特異性和高靈敏度的LC-MS/MS檢測(cè)方法是蛋白質(zhì)組學(xué)技術(shù)從基礎(chǔ)研究領(lǐng)域走向臨床實(shí)驗(yàn)室和精準(zhǔn)醫(yī)學(xué)的關(guān)鍵。
評(píng)估生物材料的一個(gè)基本要求是將其細(xì)化到分析。在蛋白質(zhì)組學(xué)中,自動(dòng)化樣本采集對(duì)于提高生物標(biāo)志物發(fā)現(xiàn)、驗(yàn)證、臨床前、臨床和藥物研究中蛋白質(zhì)的一致性和定量準(zhǔn)確性至關(guān)重要。在常規(guī)臨床實(shí)驗(yàn)室中,需要開(kāi)發(fā)和優(yōu)化精確度高、重現(xiàn)性高和穩(wěn)定好的樣品制備流程。在實(shí)現(xiàn)高通量基礎(chǔ)上不斷改進(jìn)蛋白質(zhì)組學(xué)樣品制備的自動(dòng)化技術(shù)是將質(zhì)譜和蛋白質(zhì)組學(xué)整合到個(gè)性化藥物的關(guān)鍵。
原文鏈接:
https://pubmed.ncbi.nlm.nih.gov/34786750/
- 上一篇:蛋白質(zhì)冷凍解凍過(guò)程中的結(jié)構(gòu)變化對(duì)活性影響的關(guān)鍵機(jī)制分析 2025/3/6
- 下一篇:蛋白A|Protein A 詳細(xì)介紹 2025/2/22

