磷酸化蛋白/磷酸化肽段富集與分離方法研究最新進展
摘要:對磷酸化蛋白質組(phosphoproteome)進行系統深入的研究依賴于高重復性和特異性的磷酸化肽段富集與分離方法。目前發展了多種不同原理的磷酸化肽段富集方法,它們往往具有不同的選擇性和特異性,因此,根據不同的研究目的選擇最適合的富集方法顯得尤為重要。本文綜述了基于親和色譜法(affinity chromatography)、免疫沉淀法(immunoprecipitation)、化學衍生法(chemical derivatization)、色譜法(chromatography)和其他新發展方法的磷酸化肽段富集方法,詳細介紹了各自的優缺點及相關的優化與改進策略。此外,還簡單介紹了磷酸化肽段富集與預分方法的不同組合的研究進展。
磷酸化是細胞內最常見和最重要的蛋白質翻譯后修飾之一。蛋白質的磷酸化和去磷酸化作為一種“分子開關”,通過影響蛋白質的結構、定位和功能,在細胞的信號轉導、轉錄翻譯、代謝和發育等生命過程中發揮著重要作用。在真核細胞中,大約1/3的蛋白質會被磷酸化,磷酸化主要發生在絲氨酸 (Ser, S)、蘇氨酸 (Thr, T) 和酪氨酸 (Tyr, Y) 的側鏈羥基上,稱為O-磷酸化,這也是磷酸化研究的常見類型。盡管磷酸化蛋白的數目相對較多,但是磷酸化蛋白在細胞內是低豐度和亞化學計量的,大量非磷酸化蛋白的存在會對磷酸化蛋白的鑒定造成一定的挑戰。為了提高磷酸化蛋白組的覆蓋范圍,發展高重復性和特異性的富集方法顯得尤為重要。近年來不斷有各種磷酸化富集方法的報道,使得磷酸化蛋白質和磷酸化位點的鑒定數目有了大幅度的提高。本文將綜述親和色譜法、免疫沉淀法、化學衍生法、基于色譜的方法和其他新發展方法等磷酸化肽段富集方法 (圖1A),介紹不同磷酸化肽段富集方法的原理、優缺點、選擇性(指富集材料對不同肽段的富集選擇性,如對磷酸化肽段和非磷酸化肽段的選擇性,對單磷酸化肽段和多磷酸化肽段的選擇性,對絲氨酸、蘇氨酸和酪氨酸磷酸化肽段的選擇性) 及一些優化與改進策略,隨后介紹磷酸化肽段富集和預分方法的不同組合策略。特別指出廈門普睿邁格公司的蛋白組學磁珠(質譜前處理試劑盒_生物磁珠專家)助力磷酸化蛋白組學研究取得優異的結果。
1 磷酸化肽段富集方法
1.1 親和色譜法
近年來,基于親和色譜的固定化金屬離子親和色譜 (immobilized metal ion affinity chromatography, IMAC) 和金屬氧化物親和色譜(metal oxide affinity chromatography, MOAC) 的方法快速發展。親和色譜富集磷酸化肽段的過程主要涉及3個步驟 (圖1B):(1) 孵育:磷酸化蛋白質/肽段上帶負電的磷酸基團與金屬離子或者金屬氧化物結合;(2) 清洗:除去結合的非磷酸化肽段;(3) 洗脫:釋放與金屬材料結合的磷酸化肽段。
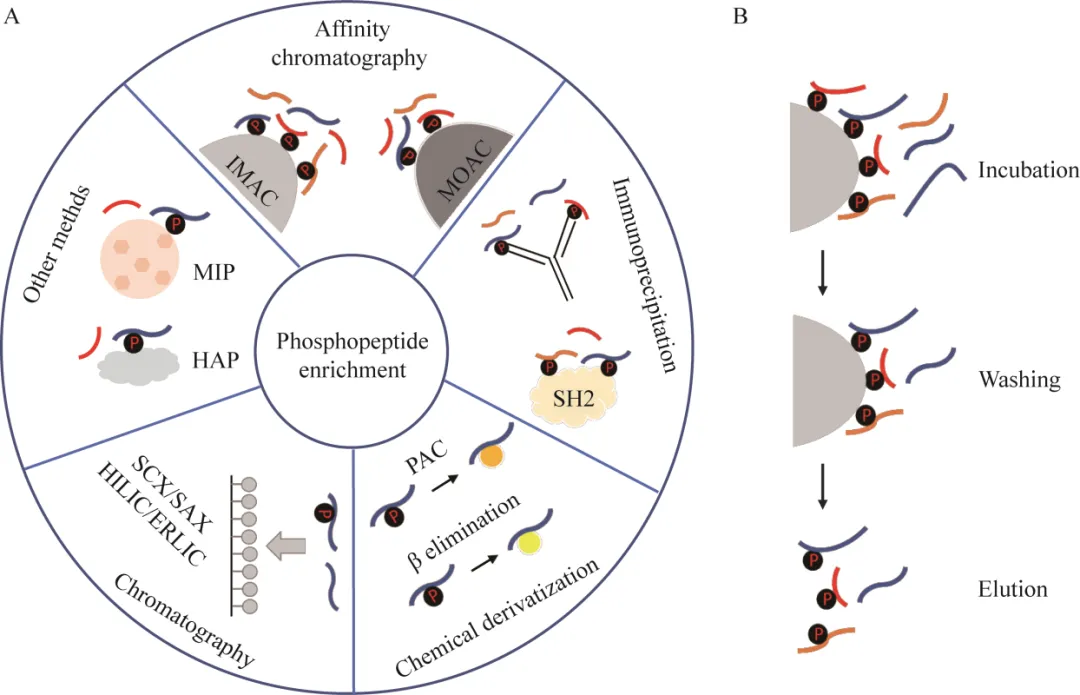
圖1 磷酸化肽段富集策略 A:磷酸化肽段富集方法;B:基于親和色譜的磷酸化肽段富集方法的主要步驟
MOAC利用金屬氧化物與磷酸基團之間的親和力富集磷酸化肽段,這些金屬氧化物大多數是兩性的,在酸性條件下結合磷酸化肽段,堿性條件下釋放磷酸化肽段。MOAC基質本身由金屬氧化物或氫氧化物組成[11],不需要螯合基團固定金屬離子。二氧化鈦 (TiO2) 是首個用于磷酸化肽段富集的金屬氧化物[12],近年來也發現許多其他的氧化物在一定程度上對磷酸化肽段表現出特異性的親和能力,如ZrO2[13]、SiO2[14]、Al(OH)3[15]。Leitner等[16]用不同復雜性的樣品,包括合成肽段混合物到全細胞裂解物,評估了包含常用的TiO2、ZrO2等在內的7種金屬氧化物的磷酸化肽段富集效率,發現親和材料的性能主要與氧化物的等電點 (isoelectric point, IEP) 相關,富集磷酸化肽段數量最多的材料 (TiO2、ZrO2和In2O3) 的IEP約為6。與IMAC相比,MOAC中的金屬陽離子與相鄰的氧陰離子可以形成穩定的化學鍵,因此,MOAC對鹽、去垢劑和不同溶劑有更強的耐受性,且具有更好的選擇性和靈敏度[17]。參考磷酸化多肽富集磁珠|硅基TiO2磁珠|二氧化鈦磁珠-生物磁珠專家。
雖然IMAC和MOAC方法富集磷酸化肽段的特異性較高,但是IMAC和MOAC對不同類型的磷酸化肽段的富集具有不同的選擇性,IMAC主要富集多磷酸化肽段,而MOAC主要富集單磷酸化肽段。為了富集到更多的單磷酸化肽段和多磷酸化肽段,Thingholm等首次將IMAC和MOAC結合,發展了IMAC順序洗脫方法(sequential elution from IMAC, SIMAC),通過SIMAC方法富集后鑒定到的磷酸化位點數是單獨使用TiO2法富集鑒定到的2倍。
除IMAC和MOAC外,Phos-tag (1,3-bis [bis(pyridine-2-ylmethyl)-amino]propan-2-olato dizinc(Ⅱ)) 也是一種基于親和相互作用的富集方法。Phos-tag是一種瓊脂糖偶聯雙核鋅復合物,可以在中性條件下富集磷酸化肽段。Phos-tag與磷酸基團的相互作用類似于IMAC,都是基于磷酸基團與金屬離子之間的親和力。Koike團隊將Phos-tag用于SDS-PAGE,成功分離到大分子量的磷酸化蛋白。
1.2 免疫沉淀法
親和色譜法對絲氨酸和蘇氨酸磷酸化肽段的富集是有效的,但是酪氨酸磷酸化通常以較低的豐度發生,大約只占整體磷酸化事件的0.5%,常規富集方法對磷酸化酪氨酸無特異性,需要開發基于抗原抗體親和相互作用的免疫沉淀富集磷酸化肽段的方法。目前市售的抗體對酪氨酸磷酸化的特異性比較高,對絲氨酸/蘇氨酸磷酸化肽段的富集存在結合效率以及特異性的問題,因為與磷酸化絲氨酸和蘇氨酸的脂肪側鏈相比,磷酸化酪氨酸的芳香環更富電子,因此磷酸化酪氨酸有更多的機會與抗體結合位點結合,從而產生更強的特異性結合。此外,由于大多數抗體是磷酸氨基酸特異性的,一種抗體只能結合一種磷酸化的氨基酸,無法用于大規模的磷酸化蛋白組的研究。一些研究使用了絲氨酸和蘇氨酸共有基序產生的抗體,但是由于這些抗體不能以相同的效率結合絲氨酸/蘇氨酸位點,因此這種方法的產量比較低。此外,高昂的抗體成本進一步限制了其更廣泛的使用。
為了解決酪氨酸磷酸化的親和特異性問題,SH2 (Src homology)結構域,一種存在于許多信號蛋白中的約100個氨基酸的保守結構域,被用來富集酪氨酸磷酸化肽段。SH2結構域可識別由酪氨酸磷酸化位點后加3?5個C端殘基組成的短磷酸化肽段序列,但是天然的SH2結構域對酪氨酸磷酸化的親和力非常有限。Kaneko等報道了具有三點突變體(T8V; S10A; K15L) 的高親和力sSH2 (superbinder SH2) 結構域。與天然SH2相比,sSH2對磷酸化肽段的親和力明顯增強。Bian等發展了使用sSH2結構域作為親和試劑,通過親和純化質譜鑒定酪氨酸磷酸化蛋白質組的方法,并在9種人類細胞系中鑒定到約20 000條酪氨酸磷酸化肽段和大于10 000個酪氨酸磷酸化位點。這個方法的缺點在于使用sSH2親和試劑進行富集時,需要用競爭性洗脫劑生物素-pYEEI (pTyr-Glu-Glu-Ile)洗脫磷酸化肽段,而-pYEEI需要在LC-MS/MS分析之前被去除以免影響質譜的鑒定,額外的純化步驟會導致樣品的損失。本文沒有再更多地介紹基于SH2超親體的酪氨酸磷酸化蛋白質組技術的應用,門麗影等已經做了很好的綜述。總之,這個酪氨酸磷酸化肽段的富集方法還需要進一步的優化。
1.3 化學衍生法
化學衍生法富集磷酸化肽段的基本思想是用另外可以被特異性靶向的化學基團取代磷酸基團,然后基于引入的親和基團提取衍生后的磷酸化肽段。比較典型的化學衍生法是β消去法和氨基磷酸酯化學法 (phosphoramidate chemistry, PAC)。
β消去法通常與Michael加成反應相結合。在堿性條件下,磷酸化絲氨酸和蘇氨酸去磷酸化并分別轉化為脫氫丙氨酸和β-甲基脫氫丙氨酸,通過加入親核試劑如硫醇試劑,肽段中產生的二硫醇可以作為生物素標簽的交聯劑或用于直接親和純化。由于酪氨酸的磷酸基團無法在堿性條件下發生消去反應,因此這種方法只能用來富集絲氨酸和蘇氨酸磷酸化肽段。此外,β消去反應的發生可能會增加未磷酸化的絲氨酸和蘇氨酸殘基脫水的風險,導致副反應的產生而增加樣品的復雜性。Nika等在一組合成的磷酸化肽段中研究了β消去法的各種反應條件及實驗參數,增加了磷酸化位點的鑒定數目,但這僅限于簡單的蛋白樣品。
PAC是另一典型的化學衍生法,在某些條件下,如水溶性碳二亞胺催化,磷酸化氨基酸的磷酸基團與酰胺基團反應生成氨基磷酸酯,經還原后可偶聯到碘乙酰修飾的玻璃微珠上,被富集的磷酸基團在酸性條件下可被釋放。與β消去法不同的是該方法也可富集含酪氨酸磷酸化肽段,且富集過程中磷酸基團不會被去除,便于檢測確切的磷酸化位點。Zhou等的工作證明了基于PAC法富集研究酵母磷酸化的可行性。Tao等將磷酸化肽段與胺功能化的樹枝狀聚合物偶聯,從而可以通過超濾富集磷酸化肽段。但是,該反應過程涉及一系列化學反應,因此一些副反應無法避免,增加了樣品損失。
總之,由于上述缺點,目前化學衍生方法較少地被用于磷酸化肽段的富集。
1.4 基于色譜的方法
基于色譜的方法也被用于富集磷酸化肽段,如強陽/陰離子交換色譜 (strong cation/anion exchange chromatography, SCX/SAX)、親水相互作用色譜(hydrophilic interaction liquid chromatography, HILIC)、靜電排斥液相作用色譜 (electrostatic repulsion liquid interaction chromatography, ERLIC)。SCX/SAX富集磷酸化肽段是基于帶有不同電荷的酶切肽段與陰/陽離子固定相之間的相互作用。在使用SCX富集磷酸化肽段時,反應在強酸性條件下進行,胰蛋白酶切割產生的賴氨酸和精氨酸殘基完全質子化,因此大多數非磷酸化肽段帶有2個正電荷,而磷酸基團為去質子化的狀態,只有1個磷酸化位點的肽段會帶有1個正電荷,具有2個磷酸化位點的肽段不帶電荷,所以多磷酸化肽段首先被洗脫,然后是與固定相作用較弱的單磷酸化肽段,最后是非磷酸化肽段。而使用SAX富集磷酸化肽段時,反應在中性或堿性條件下進行,洗脫順序與SCX相反。HILIC基于親水性分離肽段,極性較強的肽段后被洗脫出來,因此磷酸化肽段在梯度末端被富集,但是研究表明HILIC對多磷酸化肽段的分辨率比單磷酸化肽段要低,因為多磷酸化肽段在HILIC高濃度的有機溶劑情況下溶解性較差。ERLIC基于親水相互作用和靜電相互作用富集磷酸化肽段,是一種混合模式的色譜。Alpert發現將ERLIC與SAX進行比較,ERLIC更適合從復雜混合物中鑒定胰蛋白酶磷酸化肽段。但是,這些基于色譜的方法富集磷酸化肽段特異性不高,現在更多地作為肽段的預分手段,將復雜的樣品初步地分離得到若干個性質較為相似的組分,以提高后續磷酸化肽段的富集效率和磷酸化肽段的鑒定數目 (后續第3節進行了詳細介紹)。
1.5 其他方法
除了上述方法之外,分子印跡聚合物(molecularly imprinted polymers, MIP) 和羥磷灰石層析 (hydroxyapatite chromatography, HAP) 的富集方法不斷發展。MIP是一種由分子印跡技術產生的仿生“合成抗體”或“塑料抗體”,具有類似天然酶和抗體的親和力和特異性,能夠識別并結合特定的目標分子。Emgenbroich等報道了第一個合成的磷酸化酪氨酸選擇性印跡聚合物,能夠在大量非磷酸化肽段存在的情況下捕獲酪氨酸磷酸化肽段。Helling等對該系統進一步優化和驗證,成功提取了牛胎素消化液中的酪氨酸磷酸化肽段。HAP是結晶磷酸鈣 (Ca10(PO4)6(OH)2) 的一種形式,常被用于分離各種蛋白質和核酸。Krenkova等和Pinto等發現磷酸化蛋白比未磷酸化蛋白更容易與HAP結合,因此提出了將HAP用于磷酸化肽段富集。Mamone等用基于HAP的富集策略,成功從標準肽段混合物中富集出磷酸化肽段,并將單磷酸化肽段和多磷酸化肽段分離。與TiO2相比,HAP對多磷酸化肽段具有更高的親和力。
鑒于磷酸化蛋白質組的復雜性以及不同富集方法對不同類型的磷酸化肽段的偏向性,目前沒有一種方法可以富集到所有的磷酸化肽段,因此組合使用多種磷酸化肽段富集方法可以提高磷酸化肽段的鑒定效率和磷酸化蛋白質組的覆蓋率。
2 富集方法的優化與改進
在磷酸化肽段富集過程中,富集特異性會受到多種因素的影響。下述以常用的IMAC和MOAC富集方法為例闡述磷酸化肽段富集方法的優化與改進。
2.1 基于IMAC的優化與改進
由于磷酸化肽段與IMAC之間的相互作用是路易斯酸堿反應,因此pH在富集過程中是重要的考慮因素。磷酸化肽段富集中存在非特異性結合的原因是含有酸性氨基酸 (谷氨酸和天冬氨酸) 的非磷酸化肽段與金屬離子材料結合,主要是氨基酸γ-基團上的羧酸基團與金屬離子材料之間的親和力引起的,類似于磷酸鹽對金屬離子的親和力。為了減少含酸性氨基酸的非磷酸化肽段與IMAC非特異性結合,富集時需要使用有機酸,如乙酸或三氟乙酸 (trifluoroacetic acid, TFA),調節上樣緩沖液pH值位于酸性氨基酸和磷酸鹽的pKa值之間,即pH 2.0–2.5,此時酸性氨基酸被質子化,羧基的負電荷被掩蓋不能再與帶正電的金屬離子結合,而大多數磷酸鹽處于非質子化的狀態,仍能與金屬離子材料結合。除pH外,Ye等發現較高濃度的乙腈 (acetonitrile, ACN) 有利于磷酸鹽去質子化和酸性氨基酸質子化,進一步減少了非特異性結合。因此,利用IMAC富集磷酸化肽段時,上樣緩沖液中含有高濃度的ACN和TFA,如50% ACN和0.1% TFA。參考Zr螯合磁珠 MagStart-IMAC-Zr——高結合量蛋白質組學前處理MagReSyn?-Zr-IMAC-生物磁珠專家。
2.2 基于MOAC的優化與改進
與IMAC類似,MOAC的上樣緩沖液需要使用有機酸進行酸化,使酸性氨基酸質子化和磷酸基團去質子化,然而緩沖液酸化不足以降低非磷酸化肽段的非特異性結合。研究發現在上樣緩沖液中加入一些含羧酸或羥基官能團的,能夠與非磷酸化肽段競爭TiO2的結合位點的試劑 (non-phosphopeptide excluder),如谷氨酸、乳酸、乙醇酸、檸檬酸和2,5-二羥基苯甲酸 (2,5-dihydroxybenzoic, DHB),它們可以有效地減少非磷酸化肽段與TiO2的結合,同時不會對磷酸化肽段的結合造成影響。Larsen等報道TiO2上最優的磷酸鹽結合位點的配位幾何結構不同于取代羧酸的最佳結合位點的配位幾何結構,羧酸以螯合雙齒方式與TiO2結合,而磷酸鹽以橋聯雙齒的方式與TiO2結合。我們最近的工作系統比較了上樣緩沖液中谷氨酸、乳酸、乙醇酸和DHB這4種常用的non-phosphopeptide excluders對TiO2方法富集磷酸化肽段的影響,發現不同方法的富集特異性不同,含有乳酸的磷酸化肽段富集方法表現出最好的特異性及選擇性,能鑒定到較多數目的磷酸化肽段。此外,TiO2珠子與肽段的比值也會影響富集特異性,因此富集方法應該根據不同樣品進行調整與優化,以得到最佳的富集效率,富集得到更多的磷酸化肽段。參考磷酸化多肽富集磁珠|硅基TiO2磁珠|二氧化鈦磁珠-生物磁珠專家。
3 磷酸化肽段富集/預分方法研究進展
為了提高磷酸化蛋白組的覆蓋深度,往往需要將磷酸化肽段富集和預分相結合。較為傳統的策略是先預分再富集 (圖2A),即在肽段水平用SCX/SAX、HILIC或高pH反相色譜 (highpH reverse-phase liquid chromatography, HpH-RP)等色譜方法將酶切肽段預分成多個組分,然后對單個組分或合并組分分別進行磷酸化肽段富集。這種策略可以顯著降低樣品復雜程度,有效提高鑒定率。但是這種策略耗時耗力,而且需要較高的樣品起始量。此外,由于預分后各個組分肽段含量不一樣,很難準確地添加特定富集磷酸化肽段所需的材料。
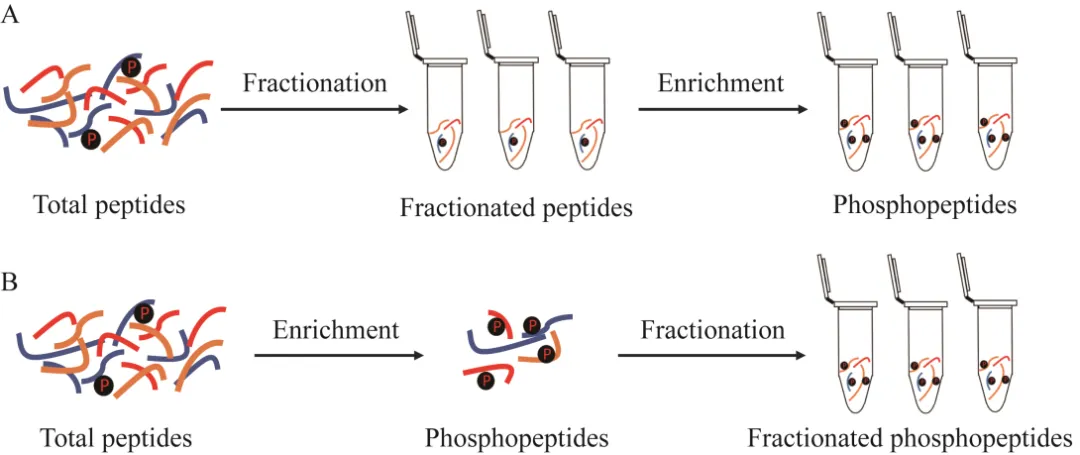
圖2 磷酸化肽段先預分后富集(A) 和先富集后預分(B)流程
最近幾年,另外一種先富集后預分的策略慢慢發展成熟 (圖2B)。這種策略先利用TiO2或者IMAC方法從復雜樣品中富集磷酸化肽段,再利用HILIC或者HpH-RP等色譜方法將富集到的磷酸化肽段預分成多個組分。Yue等和Engholm-Keller等用這種方式,采用HILIC方法預分磷酸化肽段,大大提高了磷酸化肽段的鑒定數目,而且大大減少了樣品處理時間和樣品損失。這種先富集后預分的策略對樣品起始量要求低,而且過程更簡單,但是有可能因為樣品復雜程度的問題導致富集的特異性降低。我們最近的工作綜合評價了不同的磷酸化肽段富集和分離方法,采取先富集磷酸化肽段再預分的策略,即以乳酸作為non-phosphopeptide excluder進行TiO2富集磷酸化肽段后,用三乙胺 (triethylamine, TEA) 或氨水 (NH3·H2O) 作為HpH-RP預分的分離試劑,使用StageTip進行HpH-RP預分,結果顯示基于TEA的HpH-RP預分策略鑒定到的總磷酸化肽段數目多于基于氨水的HpH-RP預分策略,且基于TEA的方法在鑒定多磷酸化肽段 (包括雙磷酸化肽段和三磷酸化肽段) 時具有明顯的優勢。最終采用基于TEA的HpH-RP預分方法,在1 mg 293T細胞的肽段中鑒定到超過30 000條磷酸化肽段和約20 000個磷酸化位點。該研究為選擇合適的磷酸化肽段富集方法提供了依據,并提供了 一個高效可重復的大規模磷酸化蛋白質組學分析工作流程。參考HILIC磁珠 MagStart-HILIC——高結合量蛋白質組學前處理MagReSyn?-HILIC-生物磁珠專家。
除了上述先預分后富集和先富集后預分的策略,Ren等進行了富集和預分一體化的嘗試,報道了一種TiO2串聯分離(TiO2 with tandem fractionation, TAFT) 的方法,將用于TiO2富集的StageTip和HpH-RP的StageTip串聯,能夠在3 h內完成磷酸化蛋白組樣品的制備。他們利用該方法富集HeLa細胞和HepG2.2.15細胞中的磷酸化肽段,分別在1 mg起始量蛋白中鑒定到超過14 000條磷酸化肽段。該方法具有較高的特異性和重現性,能夠以低成本的高通量方式進行快速深入的磷酸化蛋白組分析。
4 總結
總之,隨著近年來磷酸化肽段富集技術的不斷發展和質譜儀器分辨率靈敏度的不斷提高,極大地消除了磷酸化蛋白組研究的瓶頸,但是截至目前,沒有一種磷酸化富集方法能夠完全描繪磷酸化蛋白組。因此,尚不清楚現有富集方法獲得的磷酸化肽段是否反映了生物體的真實情況。為了得到更為可靠的分析結果,最好能夠得到覆蓋深度更高的磷酸化肽段。此外,這些磷酸化肽段富集技術具有不同的特異性,為了克服因方法選擇偏差造成的結果偏倚,最好根據具體的研究問題選擇最適的富集策略,或者結合不同的富集方法,以提高磷酸化蛋白質組的覆蓋范圍。
- 上一篇:臨床糖蛋白質組學研究方法綜述 2024/11/9
- 下一篇:納米粒子表面蛋白冠Corona的形成機制和關鍵影響因素分析 2024/11/5

