生物分離新趨勢:通過磁分離強化下游加工
作者:Julian Galbusera、Ines Zimmermann 和 Paula Fraga-García,慕尼黑工業大學
盡管傳統的填充床色譜法已經很成熟,但它需要大量的補料澄清以防止色譜柱堵塞。3 此外,多孔結構中的擴散傳質很慢,并且由于大型生物制藥模式的空間位阻,有效表面積減小。4
與傳統的小分子相比,生物制劑更復雜、體積更大,這使得這兩個因素越來越受到限制。因此,替代分離技術對于克服這些瓶頸至關重要。此外,工藝強化為增強生物工藝提供了巨大的機會。工藝強化是集成工藝設計、新技術和設備的組合,通過減少生產時間、提高產品質量和最大限度地減少資源使用來提高整體生產力。正如我們將在本文中演示的那樣,基于功能磁性顆粒的磁分離是一種非常有前途的工藝強化技術。
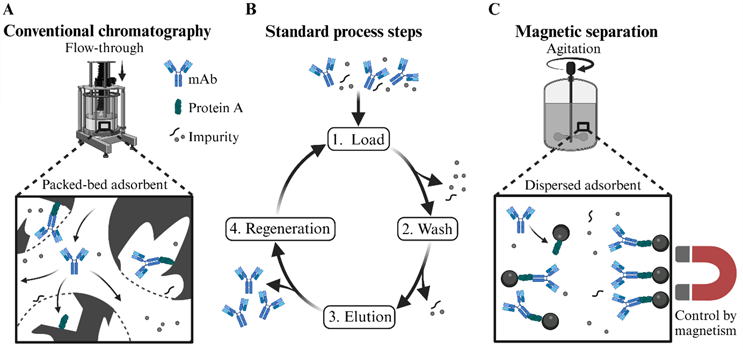
圖 1. 常規擴散限制填充床色譜法和新型磁性分離原理的示意圖。這兩種技術都描述了使用基于蛋白 A 的配體純化 mAb。(A) 在常規色譜中,使用功能性樹脂的填充床,進料流通過該填料床。相比之下,(C) 磁分離依賴于功能性磁性顆粒 (MP),這些磁性顆粒在進料流中被攪動,并且可以磁性保留以進行緩沖液交換。(B) 兩種技術的標準步驟包括將 mAb 與蛋白 A 配體結合、洗去雜質、洗脫 mAb 和再生基質。
1. 磁分離是一種新型下游工藝技術
磁性分離依賴于磁性和非磁性材料的分離。傳統上,它已應用于選礦、鋼鐵生產和廢水處理等領域,以分離具有本征磁化的物質。5,6 此外,它在實驗室的分析和診斷中得到了很好的應用,部分是在自動化高通量平臺上。7 在過去的 10~15 年中,磁性分離技術在制備型生物分離中也越來越受歡迎(參見圖 1C)。8 因此,生物材料選擇性地與磁性顆粒 (MP) 結合,例如,磁性顆粒可以通過簡單且廉價的共沉淀反應或天然來源產生。9 MP 的尺寸通常在 10 nm 至 100 μm 之間,由磁芯(例如氧化鐵)組成,可以像在色譜法中一樣使用特定應用的化學或生化涂層(例如,功能性硅烷或基于糖類的生物聚合物)和/或生物親和配體(例如,蛋白質 A)進行修飾。磁性分離通常遵循與色譜相同的步驟(上樣、洗滌、洗脫和顆粒再生,如圖 1B 所示)。
然而,與色譜中的流通柱不同,MP 在其各自的進料流/緩沖液中分散和攪拌,并且通過磁保留顆粒和更換液體來進行緩沖液交換(參見圖 1C)。與標準色譜相比,分散顆粒吸附劑產生的一般無孔性帶來了兩個決定性的優勢:增強大型物質的傳質和未澄清進料的潛在處理。此外,MP 可能具有高靶標結合載量,這對于高效處理非常重要。
2. 磁性分離在下游強化方面具有很大的潛力
每個磁選工藝通常由三個主要組件組成,可以相應地進行調整:
- 磁性粒子 /
- 其表面功能化,以及
- 磁分離裝置。
雖然由于生物制藥應用的可用系統數量有限,分離機的選擇相對簡單,但進料流和最終目標會影響 MP 的選擇及其功能化。在下文中,將討論一些用例,它們為這三個組件提供了不同的選擇(圖 2)。
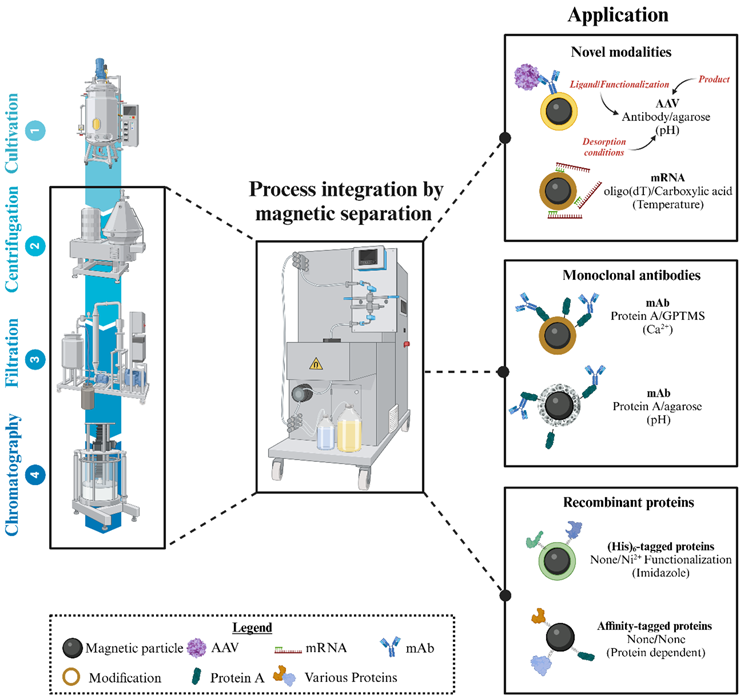
圖 2.簡化的示意圖,舉例說明了用于純化新型、mAb 和重組蛋白的選定已報道的磁性分離研究。MP 可以用特定的官能團或配體修飾,以調節靶標的結合特異性。磁性分離技術的主要優點是可以集成澄清和捕獲步驟,這些步驟通常由昂貴且耗時的離心、過濾和色譜單元作執行。
3. 單克隆抗體的純化
mAb 生產中上游工藝 (USP) 的強化導致通過灌流和高細胞密度發酵方法顯著提高滴度。因此,DSP 現在面臨著處理兩種不同起始情況的挑戰。
- 小體積高滴度的高細胞密度肉湯(補料分批)或
- 體積大,mAb 滴度低,但無細胞(灌注)。
離心和過濾作必須處理更高的細胞濃度,而色譜步驟必須處理極高的體積或高度濃縮的負載。這對傳統的純化方法構成了重大挑戰,并進一步強調了 USP 和 DSP 之間更好地保持一致的必要性。
磁分離為這兩個問題提供了潛在的解決方案。對于高細胞密度工藝,將離心、過濾和層析三個工藝步驟集成到一個分離步驟中可以解決高固體負荷的問題。相比之下,對于灌流培養,沒有固定相意味著吸附與體積無關,因此處理時間顯著縮短。
磁性顆粒的獨特特性有助于集成,并打開了一個材料平臺,如果最終目標需要,可以定制,但復雜性會增加。它們的高適應性使色譜法中已知的傳統和創新的蛋白 A 配體能夠通過共價或非共價技術固定。隨后,可以將蛋白 A 功能化的 MP 直接添加到細胞液或細胞培養上清液中。
在這里,第二個有用的特性開始發揮作用:如前所述,與傳統色譜填料相比,它們的孔隙率降低或幾乎可以忽略不計。基于此工作原理提出了幾個案例研究,盡管方法略有不同。
4. 澄清和捕獲的整合可產生高純度
在實踐中,將蛋白 A 功能化的 MP 直接添加到細胞培養液中。正如 Brechmann 等人使用蛋白 A 的瓊脂糖 MPs。10 所示,即使是高達 100 x 106 個細胞密度也不會對結合或洗脫行為產生不利影響。10, 11 純化約 16 L CHO 細胞培養物,滴度在 1.3~1.5 g?1 IgG 之間, 花了 5 ~8 個小時。因此,顆粒上結合位點的飽和在孵育后 1 小時內完成。通過集成處理,他們在洗脫液中實現了非常低的宿主細胞蛋白 (HCP) 水平 (< 5 ppm),他們將其歸因于溫和的處理,沒有明顯的細胞裂解11。
Ebeler 等人使用德國 Andritz KMPT GmbH 的符合 GMP 標準的轉子-定子高梯度磁選機 (RS-HGMS) 系統 MES 100 RS 證明了從細胞培養物中直接捕獲 mAb。12 他們報告稱,每毫升應用填料的工藝生產率是傳統色譜法的 3 倍,這凸顯了磁性分離技術的巨大潛力。
5. 缺點和瓶頸
使用瓊脂糖包被 MP 的工藝可以與色譜工藝競爭,但受到其孔隙率導致的相當緩慢的動力學的限制。開發低孔隙率的磁性介質非常重要。為了解決這個問題,我們小組開發了一種基于非功能化和非多孔 MP 的替代顆粒方法(http://www.posuichina.com/Product/Proteinextract/),具有肽標簽促進的親和配體固定。13 該方法無需耗時且昂貴的顆粒包被,減少了化學品消耗,并能夠在幾分鐘內實現快速的 IgG 相互作用。
用于 mAb 分離的常規 MP 的另一個缺點是需要酸性 pH 條件,這可能對 mAb 產品有害。我們通過將工程化鈣依賴性蛋白 A 配體共價偶聯到 GPTMS 功能化 14,該策略提供了由大部分無孔顆粒引起的更快動力學,并能夠在 pH 5.5 左右實現溫和的洗脫條件。
然而,需要解決的主要挑戰是低濃度因子和缺乏合適的大型分離器系統。例如,假設每個循環處理 25 g mAb,則以 5 g -1 的 mAb 滴度(總共 10 kg)處理 2,000 L 生物反應器的上清液,大約需要 400 次批次運行。15 即使循環時間短至 1 到 2 小時,純粹的運行次數也存在瓶頸,這主要是由于當前磁選機的過濾能力有限。針對此問題,提出了兩種策略。
首先,基于磁分離的工藝可以很好地整合,以至于可以跳過澄清和過濾步驟。這樣節省的時間可以補償一些高循環數。
其次,開發顆粒容量為幾百克到幾千克的大型磁選機至關重要。首先,Andritz KMPT GmbH 提供了帶有 10 L 腔室的 RS-HGMS,理論上可以將循環次數減少到大約 40 次。正如 Tesanovic 等人最近所描述的,結合磁選機多尺度模型的開發,16 放大將變得更加直接。基于這些模型,腔室和矩陣設計可以進行計算機優化并相應地進行調整。還應考慮到,隨著顆粒濃度的增加,洗脫可以產生更高的潛在產物濃度,因此實施額外的更小的洗脫室可能是有希望的,正如 Brechmann 等人所報告的那樣10。結合改進的分離器設計,應以連續或半連續處理為目標,例如,通過分離器的串聯或磁力離心。半連續或完全連續處理可能會顯著提高生產率,就像傳統色譜一樣。17
6. 新模式的純化
雖然 mAb 工藝受益于已建立的平臺,但基于病毒的治療、質粒、基于 RNA 的療法和 CAR T 細胞療法等新模式仍處于開發的早期階段。純化這些分子的復雜性往往受到低生產率的阻礙,這推高了成本并延遲了市場準備。18 這些新模式的工藝開發仍處于起步階段。這使得現在成為在工藝開發中實施磁性分離的理想時機,以便于以后在符合 GMP 的工藝中實施。
Turco 等人使用 RS-HGMS (Andritz KMPT GmbH) 系統從粗HEK293T細胞裂解物中純化了重組腺相關病毒 (rAAV),其中 Mag Sepharose 微珠由 rAAV 特異性配體功能化。與基于色譜的處理相比,他們的工藝實現了 63% 的回收率,顯著減少了 HCP 和 DNA,同時將生產率提高了 10 倍。18
磁性分離是一種成熟的分析規模 DNA 純化方法。因此,它也被研究用于 mRNA 的大規模純化也就不足為奇了,尤其是關于基于 mRNA 的疫苗的潛力。
在 3D 打印的一次性磁性分離室中使用用 oligo (dT) 功能化的磁珠,為生物制藥應用提供了一種有趣的方法。19 雖然缺乏大規模實例,但正如 Harrer 等人最近提出的那樣,磁性分離可能有望用于 CAR T 細胞的純化。20 由于這些分子中的大多數需要輕柔處理,因此必須研究顆粒引起的物理應力的影響。因此,目前尚不清楚開發的大型磁選機是否可以在不進一步修改的情況下用于處理新模式。正如已經描述的 mAb 工藝純化一樣,缺乏大型磁選機是進一步生產規模工藝實施的瓶頸。
7. 重組蛋白的純化
從微生物裂解物、發酵液或血清中純化生物制藥蛋白質與上述用例不同,因為它們通常涉及低價分子。因此,沒有配體或官能團化的簡單 MP 是降低成本的理想選擇。在這里,分離產量和純度可以通過正確選擇表面積與生物量比來調整。最后,它仍然是特異性和成本效益之間的賭博。
當使用非功能化 MP 時,與目標蛋白質融合的短親和肽標簽可用于實現一定的特異性。其結果是一種基于成本極低、無毒 MP 的工藝,具有高結合載量,但與功能化 MP 相比特異性較低。21
我們相信,它們用于用感興趣的細胞外產物從發酵液中原位去除產物的應用具有巨大的潛力。帶有固定化金屬離子(如 Cu2+)的 MP 是特異性更高且材料成本仍然較低的不錯選擇。22 這種方法結合了色譜中常用 (His)6-標簽的優點和磁性分離的優點。值得一提的是,色譜處理的專有技術可以廣泛應用于調整磁性分離,因為兩者都是基于吸附的單一作。在這里,磁分離的研究和技術開發程度較低,但具有設計靈活性和無傳質限制的優勢。
文獻中使用低成本或非功能化 MP 純化蛋白質的大規模工藝揭示了與參比色譜工藝相當的產量和純度。同樣,它們的主要優點是顯著縮短了處理時間,尤其是在可以省略離心或過濾步驟的情況下。然而,與 mAb 加工相同的缺點仍然存在。缺少大規模裝置的方面是重組蛋白回收更加嚴重,因為這些分子通常以更高的體積生產,進一步增加了使用目前市場上可用的小型裝置所需的循環次數。
8. 未來展望
生物制藥生產非常嚴格,與傳統層析一樣,在狹窄的窗口內需要微調和優化的參數。因此,預計未來的改進有限,真正的過程強化需要顛覆性技術——正如我們上面所展示的,磁分離技術具有巨大的潛力。然而,該技術需要進一步發展,因為市售的批量分離器會嚴重限制吞吐量和可實現的濃縮因子。在我們看來,具有增強顆粒容量和(半)連續磁分離模式的分離器是提高通量和生產率的關鍵,因此應該成為未來研發的重點。
我們小組已經致力于過程分析技術 (PAT) 的實施和實時過程控制的建模方法的開發,這對連續應用起決定性作用。16 此外,開發新型和更高效的功能性顆粒應該是另一個研究重點,因為這些顆粒顯著影響磁分離過程的適用性和生產率。廈門普睿邁格生物科技有限公司(www.posuichina.com)致力于各種功能的磁性納米顆粒的制備,并形成了豐富的研發經驗和產品。通過自動集成 MP 合成及其在生物分離應用中的應用來高效生產這些顆粒,以降低成本并全面提高工藝生產率。最后,我們想解決生物制藥行業中的一次性設備趨勢,正如 Wommer 等人所展示的那樣,可以通過磁分離室中的一次性入口來實現這一點。在我們看來,磁分離技術的三個最具決定性的優勢是
- 由于顯著減少的傳質限制和高結合載量,大量靶分子與磁性顆粒的快速相互作用,
- 集成離心、過濾和澄清步驟的能力,可實現高水平的工藝集成,以及
- 裸磁顆粒的成本效益高且簡單的大規模合成。
然而,我們知道磁分離仍處于起步階段,新技術要在嚴格監管的生物制藥行業中獲得認可并與現有技術競爭是一項挑戰。盡管如此,我們相信磁分離提供了一種有價值的方法,可以為提高整體生產率、增強可持續性、簡化加工和節省時間鋪平道路。
編者注:Galbusera 和 Zimmermann 的貢獻相同。
References:
- G. Carta, A. Jungbauer, Protein Chromatography, Wiley, 2020.
- C.L. Gaughan, The present state of the art in expression, production and characterization of monoclonal antibodies, Mol. Divers. 20 (2016) 255–270. https://doi.org/10.1007/s11030-015-9625-z.
- A.A. Shukla, L.S. Wolfe, S.S. Mostafa, C. Norman, Evolving trends in mAb production processes, Bioeng. Transl. Med. 2 (2017) 58–69. https://doi.org/10.1002/btm2.10061.
- K.M. ??cki, Introduction to preparative protein chromatography, in: Biopharmaceutical Processing, Elsevier, 2018, pp. 319–366.
- C.T. Yavuz, J.T. Mayo, W.W. Yu, A. Prakash, J.C. Falkner, S. Yean, L. Cong, H.J. Shipley, A. Kan, M. Tomson, D. Natelson, V.L. Colvin, Low-field magnetic separation of monodisperse Fe3O4 nanocrystals, Science 314 (2006) 964–967. https://doi.org/10.1126/science.1131475.
- J. Oberteuffer, Magnetic separation: A review of principles, devices, and applications, IEEE Trans. Magn. 10 (1974) 223–238. https://doi.org/10.1109/TMAG.1974.1058315.
- S. Berensmeier, Magnetic particles for the separation and purification of nucleic acids, Appl. Microbiol. Biotechnol. 73 (2006) 495–504. https://doi.org/10.1007/s00253-006-0675-0.
- S.P. Schwaminger, P. Fraga-García, M. Eigenfeld, T.M. Becker, S. Berensmeier, Magnetic separation in bioprocessing beyond the analytical scale: from biotechnology to the food industry, Front. Bioeng. Biotechnol. 7 (2019) 233. https://doi.org/10.3389/fbioe.2019.00233.
- H.-C. Roth, S.P. Schwaminger, M. Schindler, F.E. Wagner, S. Berensmeier, Influencing factors in the CO-precipitation process of superparamagnetic iron oxide nano particles: A model based study, Journal of Magnetism and Magnetic Materials 377 (2015) 81–89. https://doi.org/10.1016/j.jmmm.2014.10.074.
- N.A. Brechmann, P.-O. Eriksson, K. Eriksson, S. Oscarsson, J. Buijs, A. Shokri, G. Hj?lm, V. Chotteau, Pilot-scale process for magnetic bead purification of antibodies directly from non-clarified CHO cell culture, Biotechnol. Prog. 35 (2019) e2775. https://doi.org/10.1002/btpr.2775.
- N.A. Brechmann, H. Schwarz, P.-O. Eriksson, K. Eriksson, A. Shokri, V. Chotteau, Antibody capture process based on magnetic beads from very high cell density suspension, Biotechnol. Bioeng. 118 (2021) 3499–3510. https://doi.org/10.1002/bit.27776.
- M. Ebeler, O. Lind, N. Norrman, R. Palmgren, M. Franzreb, One-step integrated clarification and purification of a monoclonal antibody using Protein A Mag Sepharose beads and a cGMP-compliant high-gradient magnetic separator, N. Biotechnol. 42 (2018) 48–55. https://doi.org/10.1016/j.nbt.2018.02.007.
- I. Zimmermann, Y. Kaveh-Baghbaderani, F. Eilts, N. Kohn, P. Fraga-García, S. Berensmeier, Direct affinity ligand immobilization onto bare iron oxide nanoparticles enables efficient magnetic separation of antibodies, ACS Appl. Bio Mater. 7 (2024) 3942–3952. https://doi.org/10.1021/acsabm.4c00280.
- I. Zimmermann, F. Eilts, A.-S. Galler, J. Bayer, S. Hober, S. Berensmeier, Immobilizing calcium-dependent affinity ligand onto iron oxide nanoparticles for mild magnetic mAb separation, Biotechnology Reports (2024) e00864. https://doi.org/10.1016/j.btre.2024.e00864.
- B. Kelley, The history and potential future of monoclonal antibody therapeutics development and manufacturing in four eras, mAbs 16 (2024) 2373330. https://doi.org/10.1080/19420862.2024.2373330.
- M. Tesanovic, J.P. de Souza, M.Z. Bazant, S. Berensmeier, 2025. Magnetic particle capture in high‐gradient magnetic separation: A theoretical and experimental study. AIChE Journal, e18733. https://doi.org/10.1002/aic.18733.
- L. Gerstweiler, J. Bi, A.P. Middelberg, Continuous downstream bioprocessing for intensified manufacture of biopharmaceuticals and antibodies, Chemical Engineering Science 231 (2021) 116272. https://doi.org/10.1016/j.ces.2020.116272.
- F. Turco, A. Wegelius, O. Lind, N. Norrman, A.-C. Magnusson, C. Sund-Lundstr?m, B. Norén, J. Hedberg, R. Palmgren, Combined clarification and affinity capture using magnetic resin enables efficient separation of rAAV5 from cell lysate, Mol. Ther. Methods Clin. Dev. 30
- L. Wommer, W. Soerjawinata, R. Ulber, P. Kampeis, Agglomeration behaviour of magnetic microparticles during separation and recycling processes in mRNA purification, Eng. Life Sci. 21 (2021) 558–572. https://doi.org/10.1002/elsc.202000112.
- D.C. Harrer, S.-S. Li, M. Kaljanac, V. Bezler, M. Barden, H. Pan, W. Herr, H. Abken, Magnetic CAR T cell purification using an anti-G4S linker antibody, Journal of Immunological Methods 528 (2024) 113667. https://doi.org/10.1016/j.jim.2024.113667.
- S.P. Schwaminger, P. Fraga-García, S.A. Blank-Shim, T. Straub, M. Haslbeck, F. Muraca, K.A. Dawson, S. Berensmeier, Magnetic one-step purification of His-tagged protein by bare iron oxide nanoparticles, ACS Omega 4 (2019) 3790–3799. https://doi.org/10.1021/acsomega.8b03348.
- P. Fraga García, M. Brammen, M. Wolf, S. Reinlein, M. Freiherr von Roman, S. Berensmeier, High-gradient magnetic separation for technical scale protein recovery using low cost magnetic nanoparticles, Separation and Purification Technology 150 (2015) 29–36. https://doi.org/10.1016/j.seppur.2015.06.024.
- L. Wommer, P. Meiers, I. Kockler, R. Ulber, P. Kampeis, Development of a 3D‐printed single‐use separation chamber for use in mRNA‐based vaccine production with magnetic microparticles, Eng. Life Sci. (2021). https://doi.org/10.1002/elsc.202000120.
- 上一篇:生物磁性分離和重懸:深入探索 2025/5/30
- 下一篇:蛋白互作檢測之磁珠法Pull-down技術精解 2025/5/18

