Mann神出手警惕血漿蛋白組學數據中可能的污染!!血漿蛋白組學新標準?
在蛋白質組學研究領域,血液樣本作為蘊含豐富疾病信息的微創樣本為疾病標志物的發現提供了寶貴的資源。然而,血漿樣本處理過程中的污染問題始終是懸在研究者頭頂的“達摩克利斯之劍”。近日,德國馬普所的蛋白組學大神Matthias Mann,和他的知名高足Phillipp Geyer在bioarxiv上發表一篇題為“Pre-Analytical Drivers of Bias in Bead-Enriched Plasma Proteomics”的研究結果,劍指在質譜血漿蛋白組學領域一直存在的蛋白鑒定數據質量良莠不齊、缺乏標準,甚至人為數據造假的亂象。


Matthias Mann大家都很熟悉了,是當今國際蛋白組學的擎旗人。Philipp Geyer是人類血漿蛋白組計劃(HPPP)的主要負責人,也是Ions Lab的創始人,一直致力于將蛋白組學推向精準醫學產業化。其實,早在血漿蛋白質組解決方案推出之初便根據Matthias Mann團隊發表于《Embo Molecular Medicine》(IF=9.0)的血漿樣本紅細胞、血小板、凝血污染質控建議設計了“血漿質量影響因素評估”模塊,協助廣大研究者進行污染樣本剔除。

1. 納米顆粒表面蛋白冠——檢測深度與污染敏感性的平衡
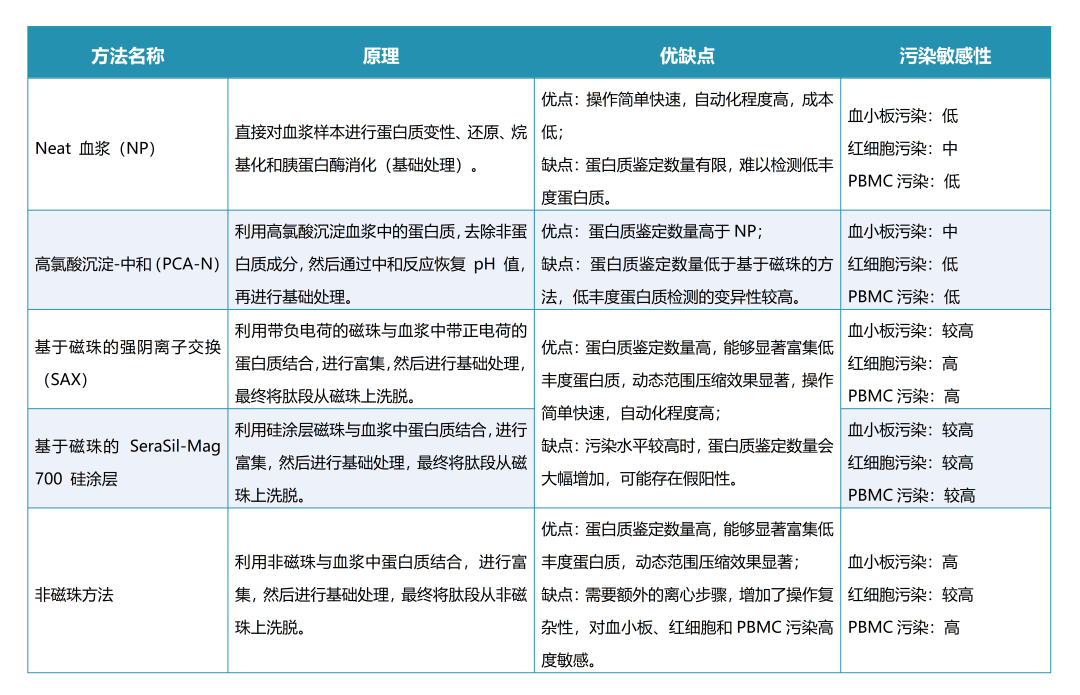
血漿蛋白質豐度范圍廣泛,其中22種高豐度蛋白含量占比超過總蛋白含量99%,低豐度蛋白占比少于1%,卻在疾病早期診斷、預后治療、生物標志物研究方面具有重要價值。為提升血漿蛋白質組隊低豐度蛋白的覆蓋度,業內專家陸續提出了多種前處理方案。Philipp Emmanuel Geyer/Matthias Mann團隊的最新研究基于常見的五種血漿蛋白質組前處理方法,通過在純凈血漿樣本中添加指定數量的血小板、紅細胞、外周血單個核細胞(PBMC),比較各前處理方法對細胞污染的抵抗性。研究發現富集技術雖能顯著提升低豐度蛋白的檢測深度,但對細胞污染高度敏感。相比之下,PCA-N流程對細胞污染表現出較強抵抗力。
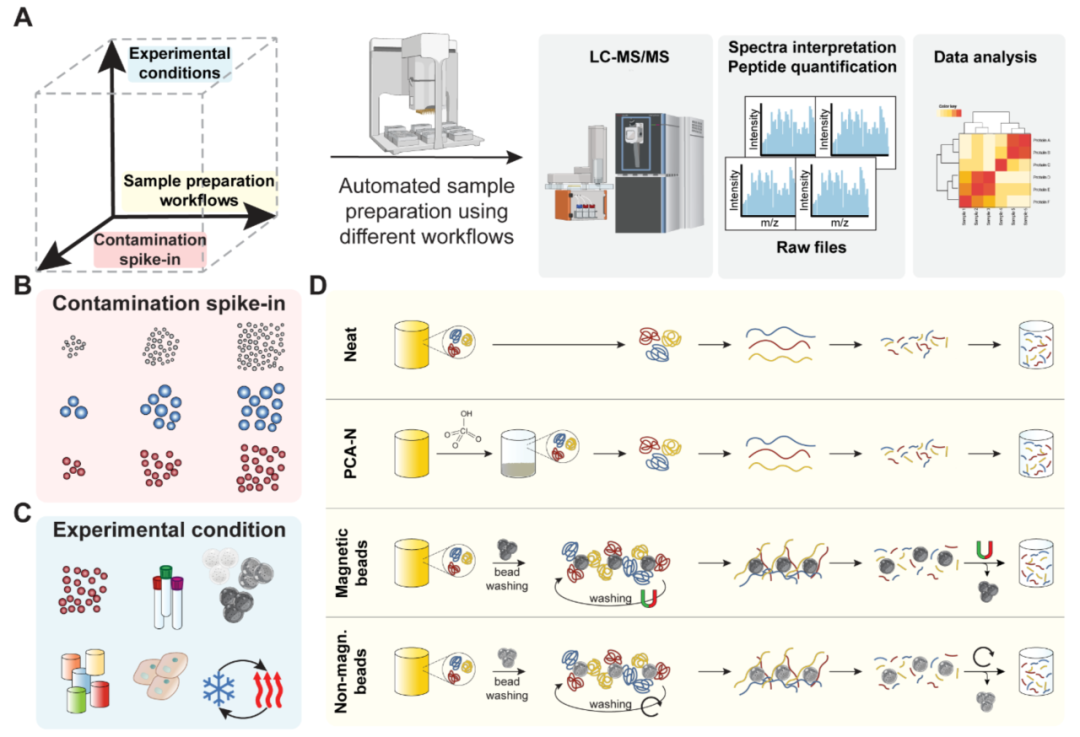
這個研究的核心精髓體現在下面一張數據圖,能給血漿蛋白組學的健康良性發展正本清源,筆者覺得有必要拿出來詳細講解。
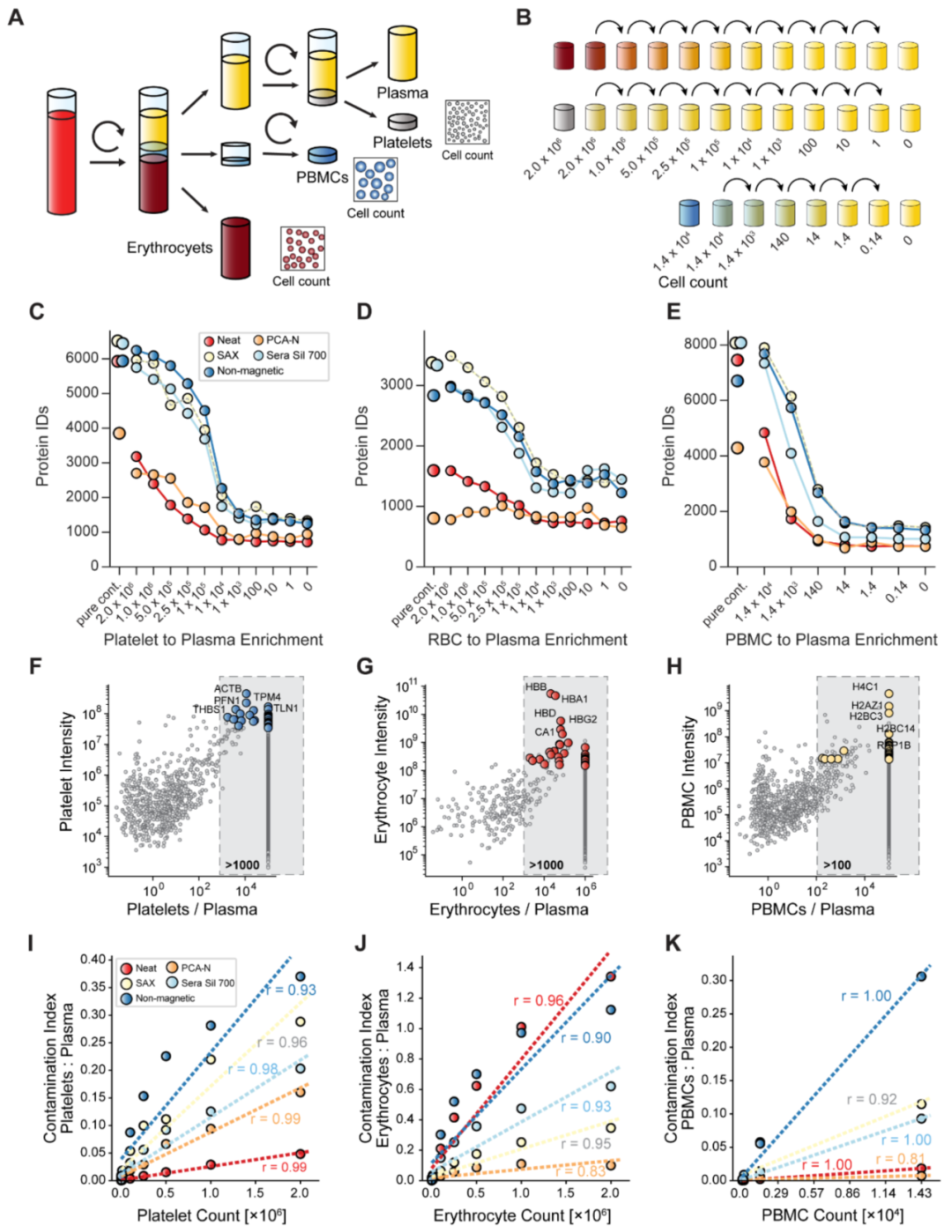
圖A是整個實驗設計,解釋了如何將一份血液樣本分成:
- 血漿(Plasma)
-
血小板(Platelet)
- 外周血細胞(PBMCs)
- 血細胞(Erthryocytes,RBC)
- Neat:未經任何蛋白富集方法;
- PCA-N:經過高氯酸沉淀并中和;
- SAX:經過帶正電荷的磁性微球(強陰離子交換法);
- Sear Sil 700:經過帶硅醇羥基基團的負電荷微球;
- Non-magnetic:經過非磁性(SiO2)微球富集;
2. 三步污染控制策略——通過分析與驗證減少污染影響
基于以上結論,為了系統地評估和減少污染對血漿蛋白質組分析的影響,該研究提出了一套“三步污染控制策略”:
單樣本污染指數評估:使用經過驗證的細胞特異性標志物面板識別和量化樣本中不同類型細胞的污染程度,計算每個樣本的污染指數。
組間污染差異檢測:比較不同組別之間的污染標記物,如果存在顯著差異,則需進一步評估污染標志物蛋白與目標生物標志物之間的相關性。
候選標志物與細胞特異性蛋白的相關性分析:計算候選生物標志物蛋白與細胞特異性標志物蛋白之間的相關性,對于相關候選生物標志物進行進一步的驗證,如使用獨立隊列驗證。
3. 標準化樣本處理流程——規避細胞污染的關鍵
為了最大限度地減少細胞污染對血漿蛋白質組學分析的影響,文章基于研究結果,提出了以下標準化樣本處理流程:
采血管
避免在同一研究中使用不同類型的抗凝劑或采血管,防止蛋白質組學模式的不同增加批次效應和變異性。建議使用EDTA抗凝劑從而在基于磁珠的富集方法中獲得最高且最穩定的蛋白質鑒定數量。肝素-Li抗凝劑會引入不同的蛋白質組模式,這可能是由于其對蛋白質結合和凝固的影響。
離心條件
推薦3000g離心30min分離血漿,該條件可最大程度減少所有類型采血管采集的血液的所有三種類型細胞污染,包括血小板、紅細胞和PBMC。尤其在使用凝膠分離管時,較低的離心力(例如500g或1000g)下由于凝膠屏障尚未完全形成,會導致渦流效應,從而使細胞物質重新懸浮,增加污染。
從實用的角度評估,建議3000g離心至少7min分離血漿,但需參考三步污染控制策略評估細胞污染影響。
凍融
反復凍融循環會導致蛋白質降解和污染標記物蛋白的釋放,推薦將樣本分裝成小份并在-80°C條件下儲存。
4. 拿到血漿蛋白組學數據,一定要警惕!
第一個警惕:警惕你的血漿樣本是否存在細胞污染!如何從蛋白組數據檢測是否存在污染?Philipp Geyer在2019年有一篇詳細的文章,描述了細胞污染評估算法,具體內容可以參考文獻(Geyer et al, EBMO Mol Med, 2019)。
第二個警惕:警惕商家過度宣傳!尤其是遇到公司宣傳能夠通過質譜方法從單個樣本中檢測6000個甚至8000個蛋白,一定要關注是否有很多血小板、血細胞、PBMCs的蛋白。要知道,目前基于NGS的蛋白組學平臺 Olink HT,僅能檢測3000個左右血漿蛋白。Somalogic 11K宣傳能檢測11K個血漿蛋白,但是其官網顯示其中55%個蛋白未經驗證。
第三個警惕:不高迷信蛋白檢測數量,穩定性更重要!蛋白檢測數量固然重要,但是蛋白鑒定的穩定性更加重要。蛋白檢測可能存在很多假陽性,可能盡管檢測到了很多蛋白,但是最終得到的蛋白標志物,就是一個假陽標志物。這白白浪費了樣本、時間、精力和錢。
廈門普睿邁格生物科技有限公司設計的多磁珠協同前處理血液樣本(http://www.posuichina.com/Product/8096211554.html),充分發揮不同磁珠表面特性結合蛋白的優勢,具有結果穩定的特點。
- 上一篇:基于納米顆粒的血漿蛋白質組學中血液成分污染的系統性評估 2025/5/17
- 下一篇:凝膠色譜填料發展簡史 – 背后的產業發展啟示 2025/5/17

