抗體純化方法簡介(附示意圖)
制備出效價高,特異性強,穩定性好的抗體是免疫學實驗取得成功的基礎,抗體質量的好壞直接影響著研究者研究的成敗,不同的免疫學實驗方法(如ELISA,IHC,IP,ICC,SDS-PAGE, WB等)對抗體的效價,濃度和純度有不同的要求。我們知道,一般免疫血清中含有特異性抗體和非特異性抗體,血清蛋白以及其他各種雜蛋白等,在制備特異性抗體過程中當抗體的效價達到實驗預期之后,我們所制備的抗體的純度關鍵取決于所選擇的純化方法。抗體經制備后需要進一步純化,純的抗體有利于保存以及排除雜蛋白對結果的影響。下面就一一介紹常用抗體純化方法及其相關原理。抗體純化方法的選擇一般取決于抗體的來源、時間的需求、成本的預算以及抗體的最終用途等。
根據純化方式可分為以下幾類:
鹽析法(飽和硫酸銨沉淀法)
該純化方法是基于在待純化免疫血清中加入飽和硫酸銨溶液,由于抗體也是一種蛋白質,其在水溶液中的溶解度是由其本身攜帶的親水基團數和電荷數決定的,當我們向抗血清中加入飽和硫酸銨溶液后,硫酸根離子和銨根離子與抗體競爭溶液中的水分子,因為硫酸根離子和銨根離子與抗體分子相比,具有更強的親水性,因此抗體分子表面的水化膜被破壞,同時其暴露出來的帶電基團被溶液中的鹽離子所中和進而導致其溶解度大大降低,依據此原理從而將其從抗血清中分離。
具體實驗步驟如下:
將5ml抗血清與0.01M PBS在離心管內等體積混合,向其中加入10ml飽和硫酸銨溶液,邊滴加邊搖勻,然后置于2到8攝氏度靜置過夜。
將步驟a中的待分離物于離心機內離心,8000r/min離心15到20分鐘,除上清。
將步驟b中離心后的沉淀用2ml 0.01M PBS 溶解,然后緩慢加入3ml 飽和硫酸銨溶液,邊滴加邊搖勻,然后置于2到8攝氏度靜置2小時。
將步驟c中的待分離物于離心機內離心,8000r/min離心15到20分鐘,除上清。
將步驟d中離心后的沉淀用1.65ml 0.01M PBS 溶解,然后緩慢加入3.35ml 飽和硫酸銨溶液,邊滴加邊搖勻,然后置于2到8攝氏度靜置2小時。
將步驟e中的待分離物于離心機內離心,8000r/min離心15到20分鐘,除上清。
將步驟f中離心后的沉淀用1ml 0.01M PBS 溶解, 轉移到MD 14000透析袋內,用0.01 M PBS進行透析,透析4次以上,每次至少1小時以上。
正辛酸-飽和硫酸銨沉淀法
該純化方法原理是:正辛酸在偏酸條件下,能與抗血清中或者小鼠腹水中的雜蛋白結合,在等電點附近將其沉淀,IgG類抗體則存在于上清液中,再利用飽和硫酸銨沉淀法即可進一步提純。
具體實驗步驟如下:
將抗血清或者小鼠腹水于離心機中離心15到20分鐘,8000r/min,以去除其中的細胞碎片或者其他沉淀物等雜質。
將1體積的抗血清或者腹水與2體積的0.06M PH 4.8的醋酸鹽緩沖液進行混合,室溫下,邊攪拌邊緩慢加入正辛酸,加入正辛酸的量為33ul/ml抗血清或者腹水。
室溫混合15到30min
2到8攝氏度靜置過夜,使其充分沉淀。
8000r/min離心15到20分鐘,棄去沉淀取上清。
將上清轉移到MD 14000透析袋內,用0.01 M PBS進行透析,透析4次以上,每次至少1小時以上。
利用鹽析法(飽和硫酸銨沉淀法)對步驟f中透析后的上清進行純化,具體實驗見上,此處不再贅述。
親和層析法
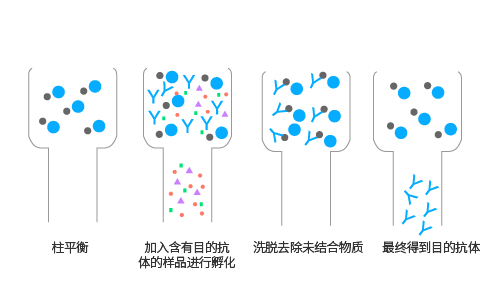
親和層析主要適用于從成分復雜且雜質含量遠大于目標物的混合物中提純目標物。如圖所示,瓊脂糖首先與介質偶聯,結合成具有特異親和性的分離介質,再加入成分復雜的混合物即樣品后,配體選擇性吸附生物活性物質(高親和力抗體),加入平衡液,洗脫去除雜質,最終獲得目標物。
protein A/protein G親和層析
通過基因工程改造的protein A和protein G能特異性結合哺乳動物IgG的Fc區段, 將protein A和protein G結合到柱料上,通過親和層析的方式,可將IgG及其亞類與片段純化出來。近年來發展的磁珠法純化是將蛋白protein A和protein G結合到磁性載體上,通過親和作用和磁分離的方式,將IgG及其亞類與片段純化出來,特別適合于小量抗體的親和純化。廈門普睿邁格生物科技有限公司開發的蛋白A、蛋白G、蛋白L、蛋白AG磁珠均具有較好的使用效果。(可參考網頁http://www.posuichina.com/Product/0293713052.html)
● protein A:分子量為42kDa,由spa基因編碼,具有5個同型的免疫球蛋白結合結構域,每個結構域由3個α螺旋構成。
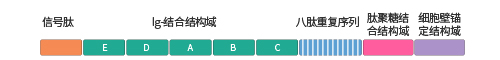
Protein A的各個結構域
● protein G:分子量為65kDa,由spg基因編碼,可結合抗體的Fc段、Fab段以及血清中的白蛋白。基因工程改造的protein G去掉了與白蛋白的結合位點,僅保留Fc結合結構域,其結合力較protein A更強。

Protein G的各個結構域
● protein A/protein G:是一種基因工程結合蛋白。它由4個protein A和2個protein G免疫球蛋白結合域組成,比單獨的protein A或protein G結合范圍更加廣泛,并將其優點融為一體,幾乎可以應用于所有種屬的IgG純化。
抗原親和純化法
利用抗原為配體的親和純化稱之為抗原親和純化,是一種高度純化蛋白類生物大分子的有效手段。此種方法中,抗原替代親和配體,被化學偶聯在凝膠介質上,目的抗體與抗原特異性結合,最終洗脫得到目的抗體。
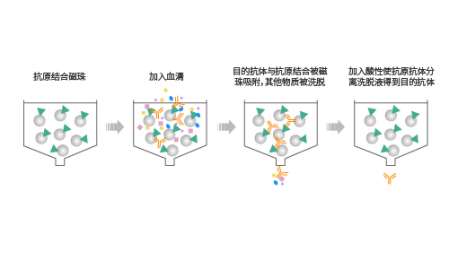
與protein A純化法的區別在于,抗原親和純化是與抗體的Fv區特異性結合,protein A純化則與抗體的Fc區特異性結合。相比較之下抗原親和純化能高度識別和結合目標抗體,因此常用于多抗的純化。
疏水作用層析法
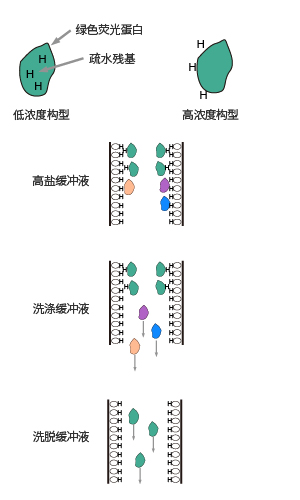
利用鹽-水體系中樣品分子的疏水基團和層析介質的疏水配基之間疏水力的不同而進行分離的一種層析方法。這種方法利用被分離組分分子表面的疏水微區,變形后暴露出的疏水殘基,或在高鹽環境下暴露于分子表面的疏水殘基與固定相的疏水性配體之間的作用強弱,依次用從高到低的離子強度洗脫液可將疏水作用由弱至強的組分分離。
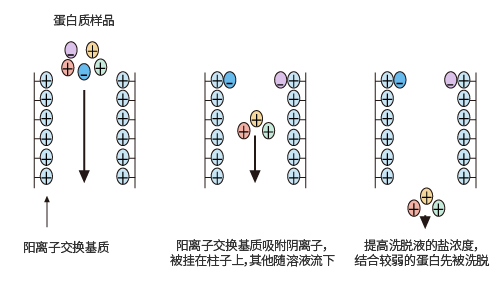
離子交換法
離子交換層析法是從復雜的混合物中,分離性質相似大分子的方法之一。由于蛋白質有等電點,當蛋白質處于不同的PH條件下,其帶電狀況也不同。陽離子交換基質結合帶有負電荷的蛋白質,所以這類蛋白質被留在柱子上,然后通過提高洗脫液中的鹽濃度等措施,將吸附在柱子上的蛋白質洗脫下來。結合較弱的蛋白質首先被洗脫下來。同樣,陰離子交換基質結合帶有正電荷的蛋白質,結合的蛋白可以通過逐步增加洗脫液中的鹽濃度或是提高洗脫液的PH值洗脫下來。
尺寸排阻色譜法
尺寸排阻色譜法又稱為分子排阻色譜法(SEC),主要根據凝膠孔隙的孔徑大小與高分子樣品分子的線團尺寸間的相對關系而對溶質進行分離的分析方法。主要用于分離分子量相差大的化合物。
原理:取決于分子在溶液中的體積,當溶液加入純化柱時,分子會依照其在溶液中的尺寸(分子平均直徑)從大到小依次分離。分子小的通過柱床流動速度相對緩慢,因為它們會不同程度的深入孔隙,而大的分子由于不能進入柱床而被快速排出,因此,通過分子體積大小洗脫樣品,可以有效進行分選。
- 上一篇:客戶采用我司鏈霉親和素磁珠在SCI期刊《Analytical 2021/3/2
- 下一篇:臨床質譜發展概況 市場前景喜人 2021/2/24

