影響納米材料表界面蛋白冠Corona形成的主要因素探討
前言
隨著納米載體的生物醫學應用的不斷發展,從分子水平上理解納米載體的體內過程極具必要性。納米載體進入體液后,可以吸附蛋白質到其表面形成組織吸附層,即蛋白冠(Protein Corana)。蛋白冠能夠影響納米載體的理化性質和后繼的生物學行為。因此,深入理解納米載體表面蛋白冠的特征和影響是調控其體內命運的首要步驟。2022年5月,美國塔夫茨大學生物醫學工程系的許巧兵教授等在Advanced Drug Delivery Reviews發表綜述,總結了納米載體的蛋白冠對其體內命運的影響,并提出了合理調控納米載體的蛋白冠,實現其體內命運調控,完成合適的生物醫學過程的設計策略。廈門普睿邁格生物科技有限公司開發的磁珠(PuriMag蛋白冠前處理磁珠試劑盒|高深度蛋白質組學-生物磁珠專家)在血漿和血清的蛋白組學研究中,具有優異的表現,已成為血液蛋白組學前處理的最常用工具.
介紹
過去幾十年里,納米乳液、脂質體、聚合物納米粒子等多種納米載體已成功用于治療劑的高效遞送。然而,由于納米粒子(NP)和生物分子之間存在復雜的相互作用,僅有一小部分納米藥物達到臨床預期要求并成功上市。1950年代和60年代初,Bangham和Vroman開創了“蛋白質吸附”的相關工作。Dawson等研究了蛋白質與粒子之間的相互作用,并于 2007年提出了“蛋白冠(PC)”的概念。隨著納米遞送系統的發展,由于這些外源性納米粒子可以和生物體液中天然存在的蛋白質相互作用,從而在其外表面形成PC,PC再次成為一項重大挑戰。這一過程受到各種生理和病理條件定性及定量的影響,嚴重影響藥物載體的穩定性、有效性和安全性。目前,許多研究集中于研究PC的形成機制、特征、對納米粒子性質和體內命運的影響,以及利用這種現象的潛在策略。
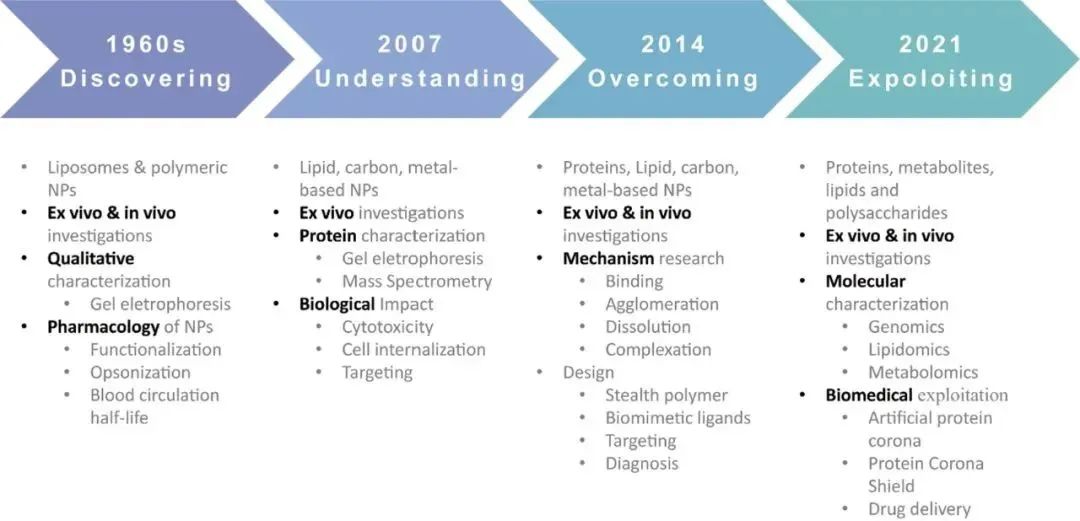
圖:蛋白冠的研究進程
蛋白冠(PC)介紹
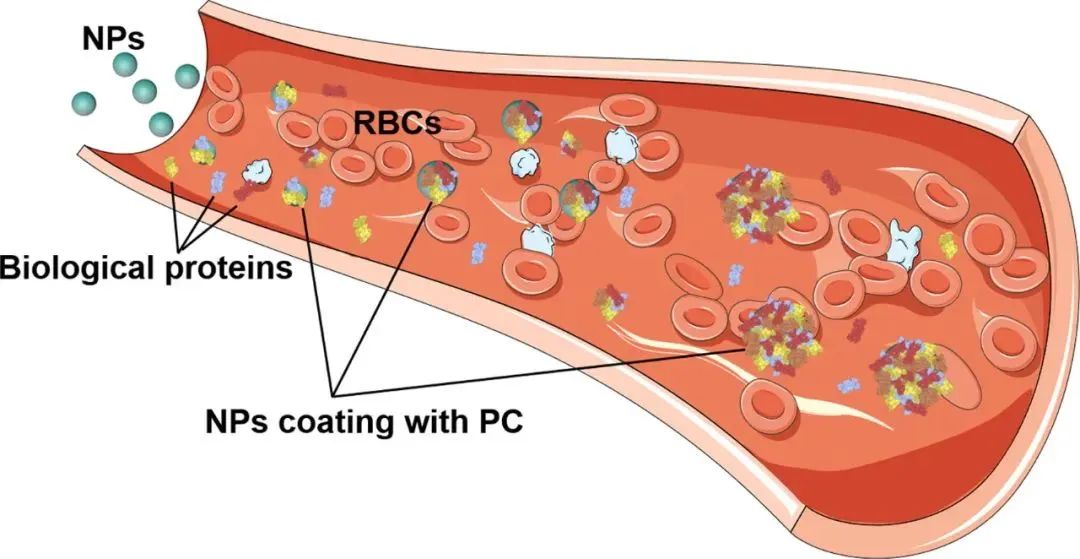
圖:納米粒子在體內過程
納米粒子(NP)在生理環境中會遇到許多成分,并產生多種相互作用,進而可能顯著改變NP 的性質和行為,包括形態、直徑、穩定性和體內命運。血清是一種復雜的液體,含有超過3700 種蛋白質,濃度為0.07g/mL。血漿蛋白是生物體液中含量最豐富的成分,其循環過程中可吸附到NP表面,并通過靜電、范德華和疏水相互作用形成稱為“PC”的涂層。PC的形成是一個動態過程,其中豐度高的蛋白質包裹在納米顆粒周圍,形成低結合親和力蛋白質的松散結構,即“軟冠”。然后,豐度較低、結合親和力較高的蛋白質逐漸取代它們,形成“硬冠”。由于與吸附蛋白質的熱力學有利相互作用,結合親和力較低的蛋白質與PC結合。然而,PC蛋白之間的相互作用可能導致蛋白質的二級和/或三級結構的構象變化。疏水性、表面修飾、形態、電荷和結合位點都是可能影響蛋白質與NP結合的因素。預測NP生理功能的能力很大程度上依賴于蛋白質的表征。
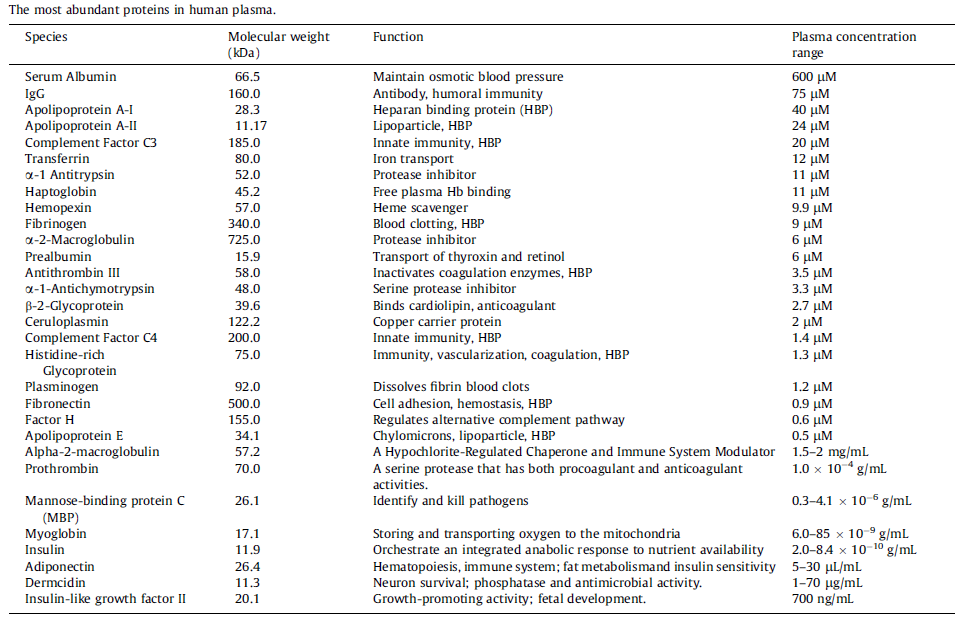
圖:人血漿中含量最豐富的蛋白質
PC形成的影響因素
影響PC形成的因素包括NP特性和溫度、pH、剪切力、循環時間、疾病條件和動物種類等外部因素。
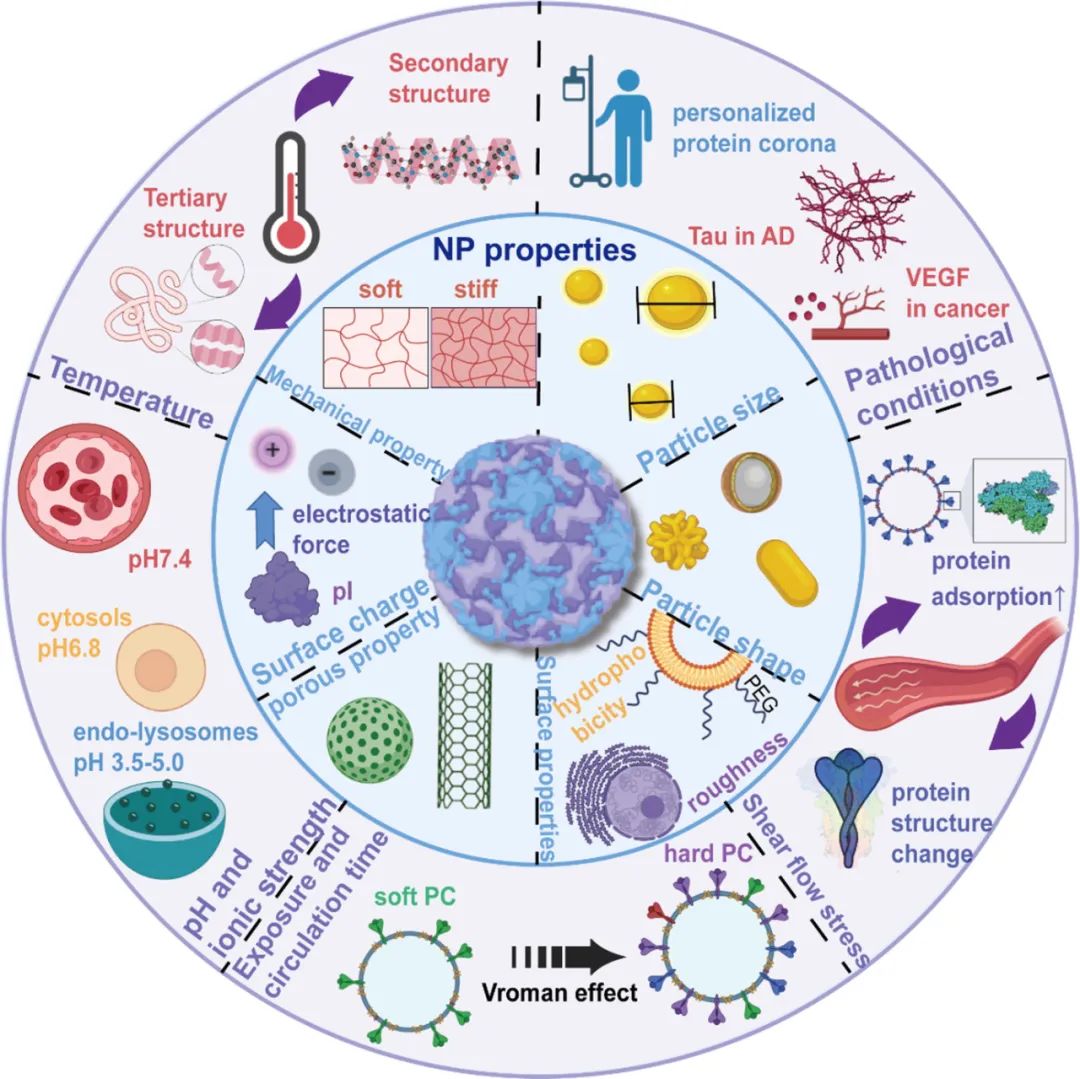
圖:納米粒子表面蛋白冠的形成
■ NP特性
NP的表面電荷、直徑、疏水性、形態和剛性等物理化學性質很大程度上會影響PC的形成。粒徑是NP的基本屬性,由于接觸面積增加,較大的NP通常比較小的NP吸附更多的蛋白質。Lima等報道聚合物NP上的PC形成具有尺寸依賴性(26、80和200nm),直徑為80nm的羧化聚苯乙烯NP的蛋白質吸附能力優于其他兩種NP,26nm的顆粒吸附的蛋白質則更少。相反,另一項研究表明,當測試直徑為100和200 nm的聚乳酸-乙醇酸共聚物 (PLGA)/PLGA-PEG-NP時,蛋白質吸附受到所用聚合物的顯著影響,而不是其尺寸。NP直徑也會影響PC結構,如果NP的粒徑過小,形成的PC會比較松散;而對于較大的納米粒子,蛋白質可以多層緊密包裹在納米粒子外表面上。Wu等使用具有不同尺寸(120、240、480nm)金納米粒子和牛血清白蛋白(BSA)分析PC結構變化和細胞攝取的差異,研究了不同粒徑對PC性能的影響。結果表明,當BSA與NP結合時,蛋白質中α-螺旋的含量增加,二級結構發生改變。然而,尺寸的影響可能會發生變化。Chan等發現,當暴露于血漿蛋白時,尺寸小于10nm的NP可以作為NP蛋白復合物中的貨物而不是載體,在這種情況下,NP的性質不會影響復合物的一般結構。
顆粒形狀是決定顆粒性能的關鍵參數,并深刻影響PC的形成和組成。Wang等探索了34nm納米球(AuNSP)、48 x 14nm納米棒(AuNR)和40nm納米星(AuNS)等三種不同形狀金納米粒子(AuNP)對胰蛋白酶和纖維蛋白原蛋白冠的功能和結構的影響。結果發現,球形AuNP比棒狀和星狀AuNP更容易被PC覆蓋,這對蛋白質二級結構的影響更大,并且與纖維蛋白原相比,胰蛋白酶促進了AuNP的聚集。通常,棒狀NP比圓形NP吸附更多的蛋白質,籠形AuNP吸附的總冠蛋白較少。
NP的表面性質(粗糙度和疏水性)也會影響PC的形成。使用基于甘露糖、半乳糖和葡萄糖、聚(2-D-糖丙烯酸乙酯)-b-聚(丙烯酸正丁酯)-b-聚(4-乙烯基吡啶) (PSugEA-b-PBuA-b-P4VP)的六種ABC三嵌段三元共聚物,直徑為130–160 nm的片狀納米顆粒, 研究粗糙度對蛋白質吸附的影響。與由聚(2-D-糖丙烯酸乙酯)-b-聚(丙烯酸正丁酯)-b-聚苯乙烯制備的光滑NP相比,與血清培養基孵育后,貼片狀NP的蛋白質吸收要少得多。
此外,結合在NP表面的白蛋白數量取決于糖的類型。基于葡萄糖的顆粒吸附80%的白蛋白;而基于甘露糖和半乳糖的NP分別僅吸附50%和30%的白蛋白。NP表面疏水性的增加也可能促進PC的形成。Lindma等通過調節N-異丙基丙烯酰胺/N-叔丁基丙烯酰胺共聚單體的比例開發了一種具有不同疏水性的納米顆粒,含有25%或更少丁基丙烯酰胺的 200 nm顆粒幾乎沒有吸附人血清白蛋白(HSA),而含有>35%丁基丙烯酰胺的顆粒完全被HSA覆蓋。而疏水性聚合物210-nm NP傾向于被免疫系統蛋白調理到比親水性NP更低的程度。此外,NP表面末端基團也會影響PC的形成。例如,酸封端的PLGA-NP比酯封端的結合蛋白數量增加。聚乙二醇化還可以通過減少納米顆粒上的蛋白質吸附來改善藥物載體的循環時間,這歸因于其親水性和非離子性質。靜脈注射后,聚乙二醇化的NP傾向于結合更多的低分子量和豐度較低的血漿蛋白。特定蛋白質如載脂蛋白E(ApoE)的結合則受到PEG密度的影響。ApoE吸附在55,90和140 nm大小的NP中隨著PEG密度超過20 個PEG5k鏈/100nm2而減少。盡管增加PEG分子量和鏈長可能會降低蛋白質吸附,但PEG-NP已被證明在重復給藥后誘導抗PEG抗體的形成,從而加速血漿清除(ABC)。少于非PEG化NP的PC涂層可以防止PEG分子免受免疫識別,從而減少抗PEG抗體的產生。因此,應該優化調整PEG密度、長度和脫落率,以同時改善循環時間,最小化ABC效應。Suzuki等發現使用具有短酰基鏈的PEG脂質可以加速PEG脫落,顯著降低抗PEG抗體的產生。此外,用羥基和兩性離子聚合物(如聚甜菜堿和多糖)修飾的NP對PC的形成具有定量和定性的影響。
此外,多孔性對PC組成也有深遠的影響。多孔NP可以結合更多分子量小于50 kDa的蛋白質(如ApoA-II),相比于致密NP,這些蛋白可以更好地滲透NP內部區域。研究人員發現,小蛋白質控制著小孔徑介孔二氧化硅納米粒子(MSN)的PC,孔徑為14 nm的MSN與致密的MSN具有相似的PC組成,而孔徑<7.4 nm的MSN表現出顯著的蛋白質模式差異。
陽離子顆粒通常比陰離子和中性粒子具有更高的PC含量和蛋白質類型,主要由帶負電荷蛋白質的靜電力驅動。Bewersdorff等發現,當使用硫醇化PEG作為配體時,陰離子NP(如 AuNSP-COOH和AuNR-COOH)會產生更大的蛋白質結合親和力,中性NP具有比金納米星和金納米籠更大的蛋白質數量。此外,PC的積累和組成受到蛋白質等電點(pI)的影響。pI-7.1富含組氨酸的糖蛋白、pI-6.6載脂蛋白B-100和pI-6.3補體C3都傾向于附著在帶負電荷的NP上;而pI-5.5 ApoA-I傾向于在帶正電的NP上積累。
NP的機械性能在PC形成中發揮關鍵作用。Zhao等制備了直徑為150-180nm的二氧化硅納米粒子,其楊氏模量范圍為704kPa、25MPa、459MPa至9.7GPa。胎牛血清(FBS)孵育結果表明,剛性增加導致總蛋白質吸收增加。最剛性的NP含有大量的補體蛋白(如補體C3、I因子、H因子、α-1B-糖蛋白和免疫球蛋白),但保留的載脂蛋白較少。剛性會影響PC中蛋白質的分子量和pI。最剛性的9.7-GPa NP主要被分子量小于150 kDa和pI小于8的蛋白質覆蓋。
■ 溫度
身體不同部位及不同條件下的體溫范圍為35.8到37.2℃。溫度是決定納米粒子蛋白冠組成的另一個關鍵因素。加熱會使溶液中的蛋白質變性并失活,形成沉淀。溫度高于或低于37℃可能會改變蛋白質的二級和三級結構,影響蛋白質在NP上的吸附。Wolfgang等報道了白蛋白、α-2-HS-糖蛋白、血清轉鐵蛋白、ApoA-I等血清蛋白可以形成溫度依賴性的蛋白冠。例如,40°C時,α-2-HS-糖蛋白與帶正電荷的79-nm NP的結合最多。金納米粒上PC的形成歸因于非硫蛋白靜電力或硫蛋白金硫共價鍵,而溫度主要影響硫蛋白結構(b-乳球蛋白,b-lg)。Huang等發現當溫度升高時,Au-S鍵的作用力減弱,蛋白質吸附量減少,NP直徑減小。溫度也會影響蛋白質對金納米粒子的吸附速度。例如,AuNP-β-lg冠的Au-S鍵形成時間在4℃時為12h,但在24℃時縮短為9h,在44℃時縮短為6 h。當溫度超過其較低的臨界溶液溫度(LCST)時,其熱響應材料出現“塌縮”和溶劑化狀態較少,因此熱響應NP的蛋白質親和力通常會升高。例如,N-異丙基丙烯酰胺(NIPAm)共聚物NP-肝素的結合常數從15℃時的1.2 x 106M(低于LCST)增加到35℃時的2.5 x 106 M(高于LCST),原因在于肝素取代了NP中的水分子。BSA、人免疫球蛋白(Ig)G、纖維蛋白原等蛋白質在37℃下聚[2-(2-甲氧基-乙氧基)乙基甲基丙烯酸酯]上的結合蛋白量比25℃時增加1.5-2.5倍。
■ pH值和離子強度
身體不同部位的pH值差異很大(胃:pH 1.5–2,血液:pH 7.4,大腸:pH 8)。NP在細胞攝取過程中會經歷多次pH轉變,從細胞外環境中的pH 7.4到細胞質中的pH 6.8,再到內溶酶體內的pH 3.5-5.0。因此,pH對PC形成的具有重要影響,因為它會影響表面電荷、蛋白質結構和分子相互作用。pH 7.4時范德華力和氫鍵相互作用增加,而在pH 6.0時主要發生靜電相互作用。此外,pH還影響蛋白質和NP的表面電荷和結構變化。例如,更多的BSA(pI 4.7)在pH 6.0時與脂質-NP的靜電相互作用比在pH 7.4時更強,因為在較低pH 時BSA上的額外正電荷有助于其吸附。PC的形成也受到氨基酸電荷變化的影響。帶負電荷的羧酸鹽修飾的NP在低pH(即5.5)下與IgG-Fc結構域的質子化組氨酸相關,而組氨酸在pH 7.4下為中性;因此,NP-IgG的靜電相互作用受到損害。對溫度敏感的NIPAm-NP在pH 6.5時與IgG相關,并且在pH 7.3時解離。
離子強度因生物體區域和生物流體的不同而異。例如,膽汁為3–15 mM,血漿為150 mM,紅細胞為200–250 mM。血漿蛋白在不同的緩沖液中可以暴露不同的結合位點。在不同pH值(6.0、6.6和7.5)和離子強度(0.15和0.30 M NaCl)下,研究了磷酸鹽緩沖液對磁性氧化鐵NP(MNP)上PC形成的影響。發現PC的穩定性隨著pH和離子強度的增加而降低,在0.05 M的磷酸鹽緩沖液和pH為6時具有最大穩定性。另有研究人員研究了緩沖液濃度對野生型β2m和檸檬酸鹽涂覆的AuNP的PC的影響。發現低濃度緩沖液可以在NP上形成更緊密的蛋白質層,而高濃度緩沖液阻礙了蛋白質和NP的結合,因此離子強度的變化可以將不穩定的、短暫的軟冠轉變為硬冠,硬冠則可以在NP上持續很長時間。
■ 暴露和循環時間
Vroman的研究表明,血清蛋白與礦物表面的結合是時間依賴性的。遷移率較高的蛋白質可能首先到達表面,然后在接下來的幾個小時內被遷移率較低的蛋白質取代,長時間暴露后形成致密的PC,這種現象稱為“Vroman效應”。一項研究測試了用含有10%FBS的細胞培養基孵育4-40nm大小的AuNP后PC的形成。發現延長孵育時間有助于NP吸附,并使PC從軟冠轉變為硬冠。例如,與10nm AuNP孵育幾分鐘形成不穩定的PC,而48小時或更長的孵育時間則形成持久性蛋白冠。然而,即使長時間孵育,在高負電荷的AuNP(10 nm,-57 mV)上也沒有形成硬PC。Hadjidemetriou等研究了靜脈注射聚乙二醇化阿霉素脂質體后的PC時間演變(10分鐘-3小時)。結果表明,給藥10分鐘后形成的PC隨著時間的推移發生了質的變化,但整體蛋白數量在研究期間沒有明顯變化。
■ 流體剪切應力
大多數NP通過靜脈注射實現遞送,因此它們暴露于不同流速的血液循環,從毛細血管中的0.085cm/s到動脈中的10cm/s以及主動脈中的60cm/s不等。血流引起的剪切壓力在 0.5和30 dyne/cm2之間波動。許多研究表明,血流速度可以影響PC的結構和組成。高流速可以增強NP上的蛋白質吸附和PC形成。利用微流控將100nm的AuNP與人血漿混合可以得到更厚的PC,其主要由免疫球蛋白(30%)組成,且帶有額外的負電荷。然而,靜態混合時,PC成分主要為組織滲漏蛋白(26%)。此外,由于蛋白質疏水區的暴露和蛋白質水解的增加,蛋白質結構也可能在剪切壓力作用下發生改變。例如,將流速從0.85 cm/s 改變為8.5 cm/s,血纖維蛋白溶酶原結構發生了很大變化。
剪切條件的影響情況也可能會受到NP表面性質的影響。Yu等在類動脈和靜脈流動以及靜態環境下利用血液循環模型研究了三種極度親水的防污材料刷上的PC,包括聚(N,N-二甲基丙烯酰胺)(PDMA)、聚(2-甲基丙烯酰氧基乙基磷酰膽堿)(PMPC)和聚[N(2-羥丙基)甲基丙烯酰胺]( PHPMA)。結果表明,在流動環境下,PDMA刷可以吸附更多的凝血蛋白、玻連蛋白、補體蛋白、纖連蛋白和而結合更少的血清白蛋白。然而,吸附在PMPC和PHPMA刷上的PC的成分在靜態和流動情況下是相似的。特別地,流動環境對PHPMA和PMPC筆刷形成的PC影響不大。此外,動態血流促進體內PC蛋白損失和蛋白交換。例如,將葡聚糖修飾的超順磁性氧化鐵納米蟲與人血漿預孵育后,靜脈注射到小鼠體內后,迅速失去相關蛋白,特別是第三種補體成分。
■ 病理條件
血漿中蛋白質的類型可能在不同的患者和疾病中有所不同,表明即使使用相同的NP,形成的PC對于每個患者都是獨一無二的,因此提出了出“個性化PC”(PPC)的概念。腫瘤環境下過表達的蛋白質,例如補體C3、血管內皮生長因子(VEGF)、富含組氨酸的糖蛋白、基質金屬蛋白酶和 kininogen-1也可能影響PC的組成。Huo等將AuNP與正常血清或患者血清共孵育,然后通過與相應抗體孵育來分析蛋白質。結果發現,健康對照組的顆粒大小比荷瘤小鼠增加更多,但與非腫瘤樣本相比,患者樣本中AuNP的PC中發現的VEGF濃度較低。正常和腫瘤血清之間的顯著差異是由于檢測了血清蛋白復合物形式的VEGF而不是單個VEGF蛋白。前列腺癌早期PC中人IgG蛋白豐富。冠狀涂層氧化石墨烯片的細胞反應和PC形成受不同患者血漿蛋白水平的影響。暴露于胰腺癌患者血漿后PC的結構和組成發生了顯著變化。由于患者血漿中存在或富集IgA和IgG自身抗體,因此患者的樣本中容易形成硬冠。與健康患者相比,將釓金屬富勒烯醇NP與肺癌患者的血漿一起孵育導致補體成分(主要是C1q)的吸附升高。PC的這些定量和定性變化可歸因于各種疾病的不同血漿蛋白質組學特征。Tavakol等研究了高血糖和高膽固醇血癥對聚苯乙烯 NP周圍PC組成的影響。結果表明,增加的葡萄糖/膽固醇對NP表面上的纖維蛋白原結合位點造成了相當大的改變。
PC對載體性質的影響
NP上PC的相互作用和形成是一個復雜的過程,NP的物理化學性質主要受PC的影響。因此,需要了解它們之間的相互作用,以獲得具有合適粒徑、形狀以及適當疏水性/親水性平衡的NP-PC復合物,以優化循環、滲透和體內穩定性。
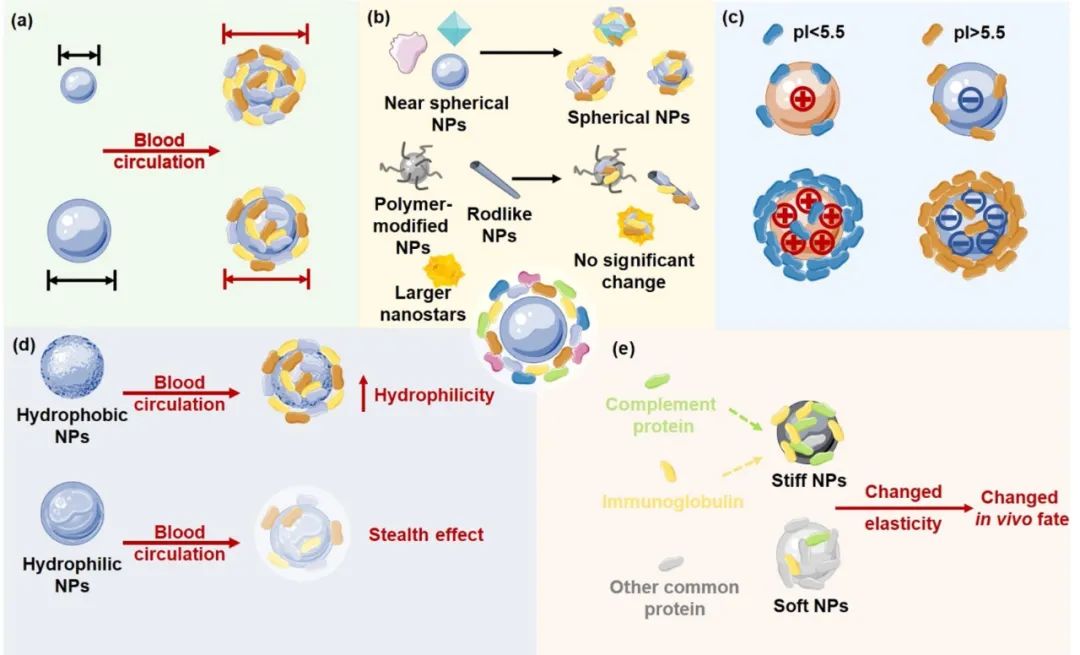
圖:蛋白冠對納米載體性質的影響
■ 粒徑和形狀的改變
當NP與周圍環境中的生物成分相互作用時,它們的大小會顯著增加,尺寸的變化也受載體特性的影響。許多研究表明,納米粒子在與生物材料相互作用后會變大,從而影響它們的體內行為。例如,在體外與100%人血漿37°C下孵育1小時和靜脈注射到小鼠體內形成PC后,PEG-聚苯乙烯NP(80 nm)或與轉鐵蛋白受體配體(83–92 nm)偶聯的NP的大小會增加。同樣,以小尺寸(30 nm)著稱的異丙氧醇NP在含有蛋白質的培養基(如人血清和FBS)中孵育后會變得更大,這可以增加它們的細胞攝取并改善其成像應用。此外,Corbo等發現靜脈注射后1小時,由于 PC 的形成,脂質體和白細胞體的直徑分別從166 nm和173 nm 增加到354 nm和324 nm。Piella等報道,檸檬酸鹽穩定的金納米粒子周圍的PC厚度主要取決于納米粒子的大小。通常,暴露于含有10%FBS的DMEM 48小時后,NP尺寸從 5.5-139 nm增加到10-174 nm。同樣,在吸附硬冠蛋白后,親水性二氧化硅納米粒子和疏水性羧基改性聚苯乙烯納米粒子的流體動力學尺寸分別從70 nm和100 nm增加到106 nm和155 nm。
PC形成后,NP的形狀也會受到影響,根據初始NP的形狀而產生各種形狀。首先,納米立方體或接近球形的納米顆粒在PC涂層后變成球形;球形NP在血液中保持其形狀,但其粒徑增加。其次,一些聚合物修飾的納米粒子,如聚乙二醇化納米粒子,在PC涂層后可能不會發生顯著變化。第三,一些NP(如AuNR)在PC形成過程中不會改變它們的形狀,盡管納米棒上的蛋白質吸附量高于納米球。第四,納米星的重塑過程取決于粒徑。例如,40 nm的納米星在與血液蛋白相互作用后被重塑,而70 nm納米星則沒有。形狀變化是至關重要的,因為NP的形狀賦予了它特定的功能。例如,納米棒很容易通過小窩體而不是溶酶體被內吞以避免降解。納米星則采用網格蛋白介導和小窩介導的內吞途徑進入細胞。
■ 表面電荷的改變
雖然NP的負電荷有利于在血液中循環,但正電荷利于細胞攝取。PC形成后,帶負電和帶正電的NP表面電荷會發生中和。粒子和蛋白質之間的相互作用驅動PC的形成,進一步誘導NP的表面電荷最終從正轉變為負。Candace等發現陽離子和陰離子NP在與血清共孵育后無法區分,PC形成后兩者都變成陰離子。在生物體液中,納米材料與生物實體(包括細胞表面和血漿蛋白)的相互作用也受到納米粒子表面電荷的影響,陰離子NP對pI > 5.5的蛋白質具有高親和力,而陽離子納米粒子對pI < 5.5的蛋白質具有更高的結合親和力。雖然許多研究表明血液中的納米顆粒結合蛋白質涉及構象變化,但與帶電NP相比,中性NP中的蛋白質構象可以得到保護。NP較高的表面電荷增加了PC的厚度,從而增加了NP的直徑和蛋白質的構象變化。
■ 疏水性和親水性平衡的改變
親水/疏水平衡決定了納米粒子的載藥量和生物相互作用。然而,PC可能會破壞這種平衡,影響NP的生物相容性和靶向能力。
最近研究表明,NP的疏水性對PC的形成有顯著影響。Gessner等發現隨著NP表面吸附血漿蛋白量的增加,NP疏水性降低。Krishnendu Saha等發現NP的疏水性隨著NP表面載脂蛋白和免疫球蛋白數量的減少而增加。Krishnendu Saha等還假設血漿蛋白的覆蓋中和了疏水性和親水性NP表面,但疏水性NP比親水性顆粒更快被調理。此外,PC組成還受NP的親水性和疏水性的影響。 Cedervall和Gessner發現在PC發展過程中,疏水性NP對載脂蛋白具有更高的結合親和力。然而,親水性NP傾向于吸附纖維蛋白原和IgG。此外,血漿白蛋白傾向于附著在疏水性NP上而不是親水性NP上。
疏水性或親水性聚合物包被的納米載體表面的蛋白質結合減少。NP的親水性聚合物涂層賦予了“隱形效應”,從而減少了吸附蛋白質的數量并保護它們不被網狀內皮系統(RES)識別。聚合物親水性、蛋白質吸附和細胞相互作用之間存在很強的相關性。當聚合物疏水性增加時,抗調理蛋白的整體粘附性降低,而細胞攝取強烈增強。
■ 彈性改變
材料的穩定性以彈性為特征,用特定物理參數(如楊氏模量)量化。納米載體的彈性在靶向、內吞作用和吞噬作用中發揮至關重要的作用。例如,較軟的顆粒(0.18-1.35 MPa)具有延長的血液循環時間和增加的器官積累,這是由于較軟的顆粒可變形為較少被巨噬細胞內化的形狀。Anselmo等發現,在體外證,與硬顆粒(~3000 kPa)相比,較軟的顆粒(~10 kPa)具有更長的循環時間和減少的巨噬細胞攝取。Tengjisi等制備了彈性模量范圍為700 kPa至10 GPa的納米膠囊,發現最硬的NP表現獨特的PC,具有高濃度的免疫球蛋白和補體蛋白。通常,PC的形成受NP彈性的影響,而反過來PC又會改變NP的彈性并影響它們的體內命運。
本文總結了納米粒子蛋白冠的形成、影響蛋白冠形成的因素以及蛋白冠對納米粒子特性的影響。廈門普睿邁格生物科技有限公司提供研究蛋白冠用的生物磁珠(PuriMag蛋白冠前處理磁珠試劑盒|高深度蛋白質組學-生物磁珠專家)。
參考文獻:
Qingqing Xiao, Makhloufi Zoulikha, Min Qiu, et al. The effects of protein corona on in vivo fate of nanocarriers. Advanced Drug Delivery Reviews 2022, 186, 114356.
- 上一篇:納米粒子表面蛋白冠Corona的形成機制和關鍵影響因素分析 2024/11/5
- 下一篇:蛋白質印跡(western blot)緩沖液和儲備液的配方 2024/10/25

